

| A. | 钢钉表面有白色沉淀 | B. | 实验2中的高锰酸钾溶液先变色 | ||
| C. | 负极的电极反应为:Fe-3e-→Fe3+ | D. | 铁钉表面有红褐色物质生成 |
分析 铁钉中含有C、Fe,钢钉中C含量较少,C、Fe和电解质溶液构成原电池,Fe易失电子作负极,正极上MnO4-得电子被还原,铁失电子先被氧化为Fe2+:Fe-2e-=Fe2+;由于是在碱性环境下,故Fe2+结合OH-生成Fe(OH)2 :Fe 2++2OH-=Fe(OH)2 ↓;Fe(OH)2 有强还原性,易被氧化:Fe(OH)2+2OH-+MnO4-=Fe(OH)3+MnO42-;Fe(OH)3不稳定,易分解:Fe(OH)3=Fe2O3 •nH2O,据此分析解答.
解答 解:铁钉中含有C、Fe,钢钉中C含量较少,C、Fe和电解质溶液构成原电池,Fe易失电子作负极,正极上MnO4-得电子被还原,铁失电子先被氧化为Fe2+:Fe-2e-=Fe2+;由于是在碱性环境下,故Fe2+结合OH-生成Fe(OH)2 :Fe 2++2OH-=Fe(OH)2 ↓;Fe(OH)2 有强还原性,易被氧化:Fe(OH)2+2OH-+MnO4-=Fe(OH)3+MnO42-;Fe(OH)3不稳定,易分解:Fe(OH)3=Fe2O3 •nH2O,
A.根据以上分析知,钢钉表面没有白色沉淀生成,故A错误;
B.通过以上分析知,实验2中的高锰酸钾溶液先发生还原反应而变色,故B正确;
C.负极反应式为Fe-2e-=Fe2+,故C错误;
D.短时间铁钉表面产生红褐色物质,故D正确;
故选BD.
点评 本题考查金属的腐蚀与防护,为高频考点,明确原电池原理及物质性质是解本题关键,注意碱性条件下和酸性条件下高锰酸根离子反应产物不同点,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①②③④ | C. | ①④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | +1价 | B. | +2价 | C. | +3价 | D. | +4价 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥⑦ | B. | ②⑤⑥⑦ | C. | ①③④⑤ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 三种溶液中c(Cl-)的关系是①=②=③ | |
| B. | 若将三种溶液稀释相同的倍数,pH变化最小的是② | |
| C. | 三种溶液中由水电离出的c(H+)的关系是①<②<③ | |
| D. | 若向三种溶液中分别加入20mL0.1mol•L-1的NaOH溶液后,pH最小的是③ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
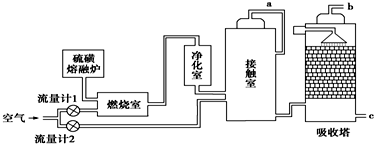
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
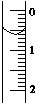 现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).
现使用酸碱中和滴定法测定市售白醋的总酸量(g•100mL-1).| 滴定次数实验数据(mL) | 1 | 2 | 3 | 4 |
| V(样品) | 20.00 | 20.00 | 20.00 | 20.00 |
| V(NaOH)(消耗) | 15.95 | 15.00 | 15.05 | 14.95 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
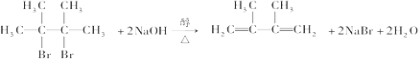 ;
;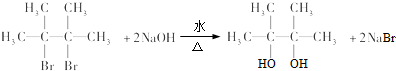 ;E与乙二醇的关系是同系物.
;E与乙二醇的关系是同系物. .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
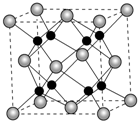 A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:
A、B、C、D为原子序数依次增大的四种元素,A2-和B+具有相同的电子构型;C、D为同周期元素,C核外电子总数是最外层电子数的3倍;D元素最外层有一个未成对电子.回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com