
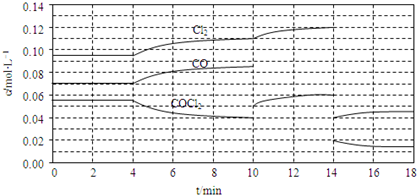
| c(CO)?c(Cl2) |
| c(COCl2) |
| c(CO)?c(Cl2) |
| c(COCl2) |
| 0.085×0.11 |
| 0.04 |


科目:高中化学 来源: 题型:
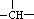 ,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)
,则该结构的烃的一氯取代物最多可能有( )种(不考虑立体异构)| A、4 | B、5 | C、6 | D、9 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、CO2的摩尔质量为44 g |
| B、1 mol N2的质量是14 g |
| C、等质量的水与质量分数98%L的硫酸混合所得溶液的质量分数大于49% |
| D、标准状况下,1 mol CO2所占的体积约是22.4 L |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
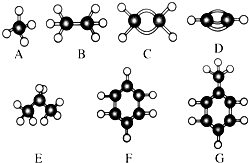 A~G是几种烃的分子球棍模型,据此回答下列问题:
A~G是几种烃的分子球棍模型,据此回答下列问题: 的名称是:
的名称是:查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、常温下pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,水的电离程度前者比后者大 |
| B、用饱和Na2CO3溶液处理BaSO4沉淀,可将BaSO4转化为BaCO3 |
| C、BaSO4(s)+4C(s)═BaS(s)+4CO(g)室温下不能自发进行,说明该反应的△H<0 |
| D、为准确测定盐酸与氢氧化钠溶液反应的中和热,所用酸和碱的物质的量应相等 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com