
| A. | 1molCl2与足量的铁反应,转移的电子数为3NA | |
| B. | 25℃,pH=13的NaOH溶液中含有OH-的数目为0.1NA | |
| C. | 标准状况下,2.24L已烷含有分子的数目为0.1NA | |
| D. | 常温常压下,Na2O2与足量H2O反应,共生成0.2molO2,转移电子的数目为0.4NA |
分析 A.氯气与铁反应生成氯化铁,氯气少量,依据氯气的量计算转移电子数;
B.溶液体积未知;
C.标况下己烷为液体;
D.过氧化钠与水反应为歧化反应,生成1mol氧气转移2mol电子.
解答 解:A.1molCl2与足量的铁反应生成氯化铁,1mol氯气参加反应生成2mol氯离子,转移的电子数为2NA,故A错误;
B.依据n=CV可知溶液体积未知,无法计算氢氧根钠离子数目,故B错误;
C.标况下己烷为液体,不能使用气体摩尔体积,故C错误;
D.过氧化钠与水反应为歧化反应,生成1mol氧气转移2mol电子,则生成0.2molO2,转移电子的数目为0.4NA,故D正确;
故选:D.
点评 阿伏伽德罗常数有关的计算,题目在注重对计算关系的考查的同时,又隐含对物质状态、物质结构考查,注意过氧化钠与水反应为歧化反应特点,注意气体摩尔体积使用条件和对象.


 天天向上课时同步训练系列答案
天天向上课时同步训练系列答案 阳光课堂同步练习系列答案
阳光课堂同步练习系列答案科目:高中化学 来源: 题型:选择题
| A. | IA族元素的金属性比IIA族元素的金属性强 | |
| B. | HF、HCl、HBr、HI的还原性从左到右依次增强 | |
| C. | 同周期非金属氧化物对应的水化物的酸性从左到右依次增强 | |
| D. | 第三周期元素的离子半径从左到右逐渐减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ②⑤ | B. | ②⑥⑧ | C. | ②③⑤⑦⑧ | D. | ①②④⑤⑧ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
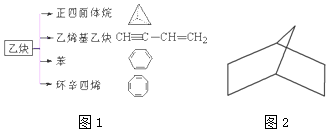
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在H2O2+Cl2=2HCl+O2反应中,每生成32g氧气,则转移2NA个电子 | |
| B. | 10mL质量分数为98%的H2SO4,用水稀释至100mL,H2SO4的质量分数为9.8% | |
| C. | 一定温度下,1molFeCl3水解生成NA个Fe(OH)3胶体颗粒 | |
| D. | 在标准状况下,2.24L苯中所含分子数约为NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
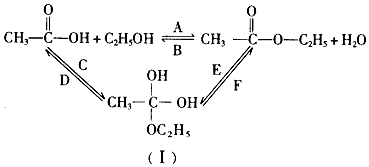
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
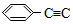 -CH=CH-CH3,有关其结构说法正确的是( )
-CH=CH-CH3,有关其结构说法正确的是( )| A. | 所有原子可能在同一平面上 | B. | 侧链所有碳原子可能共直线 | ||
| C. | 所有碳原子可能共面 | D. | 最多有18原子共面 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
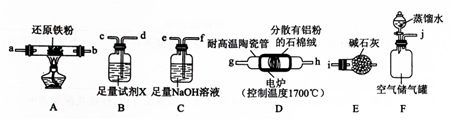
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com