

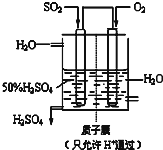
分析 无隔膜电解槽中持续电解饱和氯化钠溶液,则电解生成的氯气和氢氧化钠反应生成氯酸钠溶液,通二氧化硫和X酸还原氯酸钠溶液生成二氧化氯,再用双氧水、氢氧化钠吸收反应生成亚氯酸钠,过滤的亚氯酸钠(NaClO2)溶液通过蒸发浓缩冷却结晶得到亚氯酸钠晶体,以此解答.
(1)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸.
(2)H2O2不稳定,温度过高,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解.
(3)根据图象可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O.
(4)根据ClO2将CN-氧化,生成了两种无毒无害的气体即二氧化碳和氮气来书写;根据方程式计算.
解答 解:(1)由于ClO2气体在中性和碱性溶液中不能稳定存在,所以只能在酸性环境中存在.由于在酸性条件下,氯酸钠容易和盐酸发生氧化还原反应,所以X应该是硫酸,
故答选:B;
(2)H2O2不稳定,温度过高分解生成水和氧气,H2O2容易分解,吸收塔的温度不能过高,其目的是防止H2O2分解,
故答案为:防止H2O2分解;
(3)根据图象可知,pH≤2时ClO2被还原为Cl-,所以该反应的离子方程式是:2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O,
故答案为:2ClO2+5S2-+8H+=2Cl-+5S↓+4H2O;
(4)ClO2将CN-氧化,生成了两种无毒无害的气体即二氧化碳和氮气,所以离子方程式为:2ClO2+2CN-=2Cl-+2CO2+N2↑;根据方程式1molCN-离子消耗1mol二氧化氯,所以处理100m3这种污水,至少需要ClO2为$\frac{100×1{0}^{3}×a×1{0}^{-3}g}{26}$=$\frac{100a}{26}$=$\frac{50a}{13}$,
故答案为:2ClO2+2CN-=2Cl-+2CO2+N2↑;$\frac{50a}{13}$.
点评 本题以学生比较陌生的亚氯酸钠制备为背景,以过氧化氢法制备亚氯酸钠为主线,考查学生阅读题目获取信息的能力、考查对氧化还原反应相关知识的运用以及有关实验操作综合运用能力,题目难度中等.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案 目标测试系列答案
目标测试系列答案科目:高中化学 来源: 题型:解答题
 工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作:
工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置.实验时按如下步骤操作: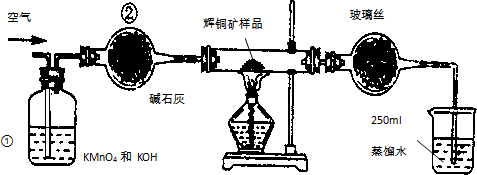
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
| 滴定前刻度/mL | 滴定后刻度/mL | ||
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 )可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
)可用于配制康乃馨型香精以及制异丁香酚和香兰素等,合成丁子香酚的一种路线如下:
 (X代表卤素原子);
(X代表卤素原子);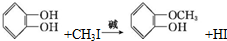 .
. .
. .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

| 离子 | Fe3+ | AP+ | ZrO2+ |
| 开始沉淀pH | 1.9 | 3.3 | 6.2 |
| 完仝沉淀pH | 3.2 | 5.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na2S有强还原性(1)用于除去废水中的Cu2+ 和Hg2+(2) | |
| B. | CaCO3是难容物(1)CaCO2溶液中通入CO2产生白色沉淀(2) | |
| C. | 浓HSO4有强氧化性(1),浓H2SO4可用于干燥SO2(2) | |
| D. | Zn具有还原性和导电性(1)可用锌锰干电池的负极材料(2) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用100mL容量瓶配制50mL 0.1mol/L的盐酸 | |
| B. | 用10mL 量筒量取5.2mL盐酸 | |
| C. | 用托盘天平称取25.12g NaCl固体 | |
| D. | 用pH试纸测得某溶液的pH值为12.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com