
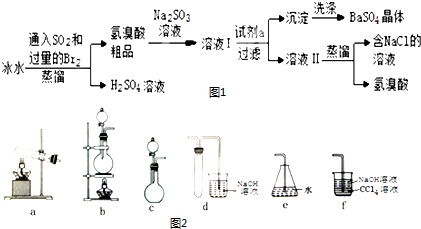
| ||


 寒假天地重庆出版社系列答案
寒假天地重庆出版社系列答案科目:高中化学 来源: 题型:
| 分类标准 | 碱性氧化物 | 强电解质 | 含氧酸 | 非电解质 |
| 属于该类的物质 | ① | NaOH | ② | ③ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③⑤ | B、②④ |
| C、①③④⑤ | D、①②③④⑤ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、①②③④ | C、②④ | D、④ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、标准状况下,22.4L的CCl4中含有的分子数为NA |
| B、18gD2O中含有的电子数为NA |
| C、1L1 mol/L的盐酸溶液所含的分子数为NA |
| D、4 g氦气中所含的质子数为2 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:
(1)广州亚运会“潮流”火炬内熊熊大火来源于丙烷的燃烧,丙烷是一种优良的燃料.试回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、滴定管用水洗后,未用标准溶液润洗就装入标准溶液 |
| B、锥形瓶盛待测液前,用待测液润洗 |
| C、读数时,滴定前仰视,滴定后俯视 |
| D、滴定结束后,发现碱式滴定管尖嘴处悬挂一滴碱液 |
查看答案和解析>>
科目:高中化学 来源: 题型:
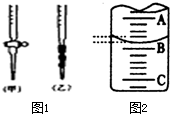 某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:
某课外兴趣小组欲测定某NaOH溶液的浓度,其操作步骤如下:| 滴定次数 | 待测液体积(mL) | 标准盐酸体积(mL) | |
| 滴定前读数(mL) | 滴定后读数(mL) | ||
| 第一次 | 20.00 | 0.52 | 25.42 |
| 第二次 | 20.00 | 4.07 | 29.17 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com