
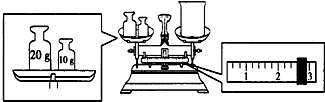
分析 (1)天平称量物体时遵循左物右码的原则,天平平衡原理:左盘物体质量=右盘砝码质量+游码质量;根据m=nM=cvM计算溶质NaOH的质量;
(2)容量瓶带有活塞,使用过程中需要上下颠倒,使用容量瓶前必须进行的一步操作是检漏;
(3)根据c=$\frac{n}{V}$分析操作对溶质的物质的量或对溶液的体积的影响判断.
解答 解:(1)因天平的称量原理:左盘物体的质量=右盘物体的质量+游码的读数,所以烧杯的实际质量为30g-2.6g=27.4g,因配制溶液的体积为240ml,而容量瓶的规格没有240ml,只能选用250ml,NaOH的质量m=cvM=1.0mol•L-1×0.25L×40g/mol=10.0g;
故答案为:27.4;10.0;
(2)容量瓶带有活塞,使用过程中需要上下颠倒,使用容量瓶前必须进行的一步操作是检漏;
故答案为:检查容量瓶是否漏液;
(3)A.转移溶液时不慎有少量洒到容量瓶外面,导致溶质部分损耗,溶质的物质的量偏小,溶液浓度偏低,故A不选;
B.定容时俯视刻度线,导致溶液体积偏小,溶液浓度偏高,故B选;
C.未冷却到室温就将溶液转移到容量瓶并定容,冷却后,溶液体积偏小,溶液浓度偏高,故C选;
D.定容后塞上瓶塞反复摇匀,静置后,液面低于刻度线,再加水至刻度线,导致溶液体积偏大,溶液浓度偏低,故D不选;
故选:BC.
点评 本题考查了一定物质的量浓度溶液的配制以及误差分析,难度不大,注意实验的基本操作方法和注意事项.


科目:高中化学 来源: 题型:推断题
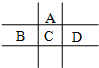 有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素在周期表中的位置如图所示,其中C元素的最高价氧化物对应的水化物浓溶液是一种常见的干燥剂.D在海水中大量富集.E的氧化物是两性氧化物,回答下列问题:
有A、B、C、D、E五种短周期元素,已知A、B、C、D四种元素在周期表中的位置如图所示,其中C元素的最高价氧化物对应的水化物浓溶液是一种常见的干燥剂.D在海水中大量富集.E的氧化物是两性氧化物,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
.| 0.01mol/LKIO3酸性溶液 (含淀粉)的体积/mL | 0.01mol/L Na2SO3溶液 的体积/mL | H2O 的体积 /mL | 实验温 度/℃ | 溶液出现 蓝色时所 需时间/s | |
| 实验1 | 5 | V1 | 35 | 25 | |
| 实验2 | 5 | 5 | 40 | 25 | |
| 实验3 | 5 | 5 | V2 | 0 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 标准状况下,11.2 L乙醇所含分子数为0.5NA | |
| B. | 40 g氢氧化钠含有氧原子数为NA | |
| C. | 1mol任何纯净物都含有6.02×1023个原子 | |
| D. | 标准状况下,22.4 L氢气含有NA个氢原子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①②③ | B. | ②③④ | C. | ①③④ | D. | ③④ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com