
50mL质量分数为35%、密度为1.24g/mL的硫酸中,硫酸的物质的量浓度为()
A. 0.044mol/L B. 0.44mol/L C. 4.4mol/L D. 44mol/L
科目:高中化学 来源: 题型:
关于溴乙烷与NaOH的乙醇溶液反应说法正确的是()
A. 该反应是溴乙烷的水解反应
B. 往反应后的溶液中直接加入AgNO3溶液检验是否有Br﹣生成
C. 该反应产物中有水、钠盐和不饱和烃
D. 生成的气体可直接通入到溴水中检验是否有乙烯生成
查看答案和解析>>
科目:高中化学 来源: 题型:
下列能确认化学平衡一定发生移动的是()
A. 化学反应速率发生改变
B. 由气体参加的可逆反应达到平衡后,改变体系压强
C. 由于某一条件的改变,使平衡混合物中各组分的浓度发生变化
D. 有气体参加的可逆反应达到平衡后,改变体系的温度
查看答案和解析>>
科目:高中化学 来源: 题型:
除去粗盐中的Ca2+、Mg2+、SO42﹣及泥沙,可将粗盐溶于水,然后进行下列5 项操作:①过滤;②加过量的氢氧化钠溶液;③加适量的盐酸;④加过量的碳酸钠溶液; ⑤加过量的氯化钡溶液.下列正确的操作顺序是()
A. ①④②⑤③ B. ⑤②①④③ C. ④①②⑤③ D. ②⑤④①③
查看答案和解析>>
科目:高中化学 来源: 题型:
用NA表示阿伏德罗常数,下列叙述正确的是()
A. 标准状况下,22.4LH2O含有的分子数为 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 通常状况下,NA 个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5 mol/L的MgCl2溶液中,含有Cl﹣ 个数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
用98%的浓H2SO4(ρ=1.84g.cm﹣3)配制1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序 排列,选择正确的是()
排列,选择正确的是()
①玻璃棒 ②胶头滴管 ③100mL容量瓶 ④托盘天平 ⑤50mL烧杯 ⑥10mL量筒 ⑦100mL量筒 ⑧移液管 ⑨滴定管.
A. ⑥③⑧⑤①② B. ⑥⑤③①⑨② C. ④⑤③②①⑨ D. ⑥⑤①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
实验室需要配制0.1mol•L﹣1 CuSO4溶液480mL.
按下列操作步骤填上适当的文字,以使整个操作完整.
(1)选择仪器.完成本实验所必需的仪器有:托盘天平(精确到0.1g)、药匙、烧杯、玻璃棒、 、 以及等质量的两片滤纸.
、 以及等质量的两片滤纸.
(2)计算,应选择下列正确
A.需要CuSO4固体8.0g B.需要CuSO4•5H2O晶体12.0g
C.需要CuSO4•5H2O晶体12.5g D.需要CuSO4固体7.7g
(3)称量.所用砝码生锈则所配溶液的浓度会偏高(填“偏高”、“偏低”或“无影响”).
(4)溶解、冷却,该步实验中需要使用玻璃棒,目的是 .
(5)转移、洗涤.在转移时应使用玻璃棒引流,需要洗涤烧杯2~3次是为了 .
(6)定容,摇匀.
(7)将配好的溶液静置一段时间后,倒入指定的试剂瓶,贴好标签,注明配制的时间、溶液名称及浓度.
(8)在配制过程中,某学生观察定容时液面情况如图所示,所配溶 液的浓度会 (填“偏高”、“偏低”或“无影响”).

查看答案和解析>>
科目:高中化学 来源: 题型:
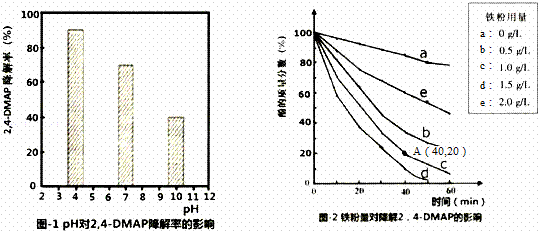
利用Na2S2O8产生的强氧化性SO4﹣•(自由基)降解有机污染物是目前最具潜力的高级氧化技术.文献报道某课题组探究pH,单质铁和Na2S2O8的浓度对降解2,4﹣DMAP(2,4﹣﹣甲基苯酚)效率的影响.
(1)探究溶液酸碱性的影响:将等量的2,4﹣DMAP加入到不同pH的Na2S2O8溶液中,结果如图1所示.由此可知:溶液酸性增强, (填“有利于”或“不利于”)Na2S2O8产生SO4﹣•.
(2)探究铁粉用量的影响:
①实验前,先用0.1mol•L﹣1 H2SO4洗涤Fe粉,其目的是 ,后用蒸馏水洗涤至中性;
②相同条件下,取不同量处理后的铁粉分别加入c(2,4﹣DMAP)=1.0×10 ﹣3mol•L﹣1、c(Na2S2O8)=4.2×10﹣3mol•L﹣1的混合溶液中,实验结果如图2所示.其中降解效率最好的铁粉用量是1.5g/L;计算从反应开始到A点时,2,4﹣DMAP降解的平均反应速率为 (忽略反应过程中溶液总质量变化).
③已知:2Fe+O2+2H2O=2Fe2++4OH﹣,S2O8﹣+Fe2+=SO4﹣+SO42﹣+Fe3+此外还可能会发生:SO4﹣+Fe2+=SO42﹣+Fe3+.当铁粉加入量过大时,2,4﹣DMAP的降解率反而下降,原因可能是(用离子方程式表示). .
(3)探究Na2S2O8浓度的影响:填写下表中空格,完成实验方案.
序号、物理量 M(Fe粉)/g V/mL V/mL 收集数据和得出结论
1 100 0.3 50 50
2 100V(污水)/mL 0.3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com