
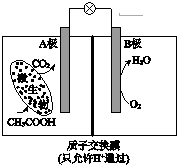
| A. | 外电路电子从B极移向A极 | |
| B. | 溶液中H+由B极区移向A极区 | |
| C. | 电池工作一段时间后B极区溶液的pH减小 | |
| D. | A极电极反应式为:CH3COOH-8e-+2H2O=2CO2+8H+ |
分析 根据图知,A电极上C元素化合价升高失电子,则A是负极、B是正极,负极反应式为CH3COOH-8e-+2H2O═2CO2↑+8H+,电解质溶液呈酸性,则正极反应式为O2+4e-+4H+=2H2O,据此分析解答.
解答 解:根据图知,A电极上C元素化合价由0价变为+4价,则A是负极、B是正极,负极反应式为CH3COOH-8e-+2H2O═2CO2↑+8H+,电解质溶液呈酸性,则正极反应式为O2+4e-+4H+=2H2O,
A.通过以上分析知,A是负极、B是正极,电子从A流向B,故A错误;
B.电池内电解质溶液中所含的H+由负极A移向正极B,故B错误;
C.B极为正极,正极反应式为O2+4e-+4H+=2H2O,正极上消耗氢离子,所以溶液pH增大,故C错误;
D.A电极上失电子发生氧化反应,则A极的电极反应为:CH3COOH-8e-+2H2O═2CO2↑+8H+,故D正确;
故选D.
点评 本题考查了原电池原理的应用,题目难度不大,注意把握原电池反应中元素化合价的变化以及电极的判断和电极方程式的书写,侧重于考查学生的分析能力.


科目:高中化学 来源: 题型:解答题
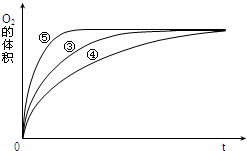 某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.
某实验小组以H2O2分解为例,研究浓度、催化剂、溶液酸碱性对反应速率的影响.在常温下按照如表方案完成实验.| 实验编号 | 反应物 | 催化剂 |
| ① | 10mL2% H2O2溶液 | 无 |
| ② | 10mL5% H2O2溶液 | 无 |
| ③ | 10mL5% H2O2溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ④ | 10mL5% H2O2溶液+少量HCl溶液 | 1mL0.1mol•L-1FeCl3溶液 |
| ⑤ | 10mL5% H2O2溶液+少量NaOH溶液 | 1mL0.1mol•L-1FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
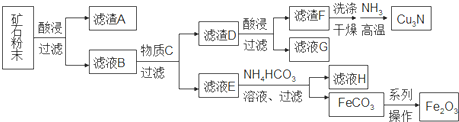
| A. | 在生成Cu3N的反应中,氨气做氧化剂 | |
| B. | 加入NH4HCO3溶液在生成白色沉淀的同时会放出有刺激气味的气体 | |
| C. | 虑液G可以并入滤液E加以利用 | |
| D. | 由FeCO3转化为Fe2O3的操作包括洗涤、干燥、空气中煅烧 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X的原子序数一定大于Y | B. | 第一电离能Y可能大于X | ||
| C. | 简单离子的半径:Xm->Yn- | D. | 气态氢化物的稳定性:HmX强于HnY |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 将苯和溴水混合后加入Fe粉制溴苯 | |
| B. | 为检验皂化反应进行程度,取几滴反应液,滴入装有热水的试管中,振荡,若无油滴浮在液面上,说明油脂已完全反应 | |
| C. | 检验淀粉在稀硫酸催化条件下水解产物的方法是:取适量水解液于试管中,加入少量新制Cu(OH)2悬浊液,加热煮沸,观察是否出现红色沉淀 | |
| D. | 探究化学反应的限度:取5ml 0.1mol/LKI溶液,滴加0.1mol/LFeCl3溶液5-6滴,充分反应,根据溶液中是否含有碘单质和碘离子判断该反应有一定限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H>0
甲醇可以与水蒸气反应生成氢气,反应方程式如下:CH3OH(g)+H2O(g)?CO2(g)+3H2(g)△H>0查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.1mol Mg在空气中完全燃烧生成MgO和Mg3N2,转移的电子数为0.2NA | |
| B. | 在标准状况下,2.24L乙烷中含有的化学键数为0.6NA | |
| C. | 100mL 0.1mol•L-1 Na2SO4溶液中含有的O原子数为0.04NA | |
| D. | 25℃时,1.0L pH=3的CH3COOH溶液中含有的H+数小于10-3 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氯水应保存在棕色试剂瓶内:2HClO$\frac{\underline{\;光照\;}}{\;}$H2O+Cl2↑ | |
| B. | 氯水具有杀菌、漂白作用:Cl2+H2O?HCl+HClO | |
| C. | 将氯水滴到淀粉KI试纸上,试纸变蓝:Cl2+2I-=2Cl-+I2 | |
| D. | 在实验室用漂白液和适量稀盐酸制取少量氯水:ClO-+Cl-+2H+=Cl2+H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com