
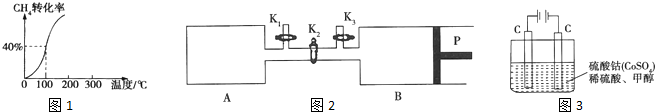
| 3 |
| 5 |
| ||
| △t |
| ||
| 5min |
| 0.6mol?L-13×0.2mol?L-1 |
| 0.3mol?L-1×0.8mol?L-1 |
| 0.6mol?L-13×0.3mol?L-1 |
| 0.9mol?L-1×0.3mol?L-1 |
| 1mol |
| 1mol+1mol+1mol |
| 1 |
| 3 |
| 1 |
| 3 |


科目:高中化学 来源: 题型:
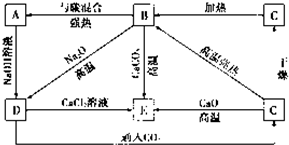 几种含硅元素的物质之间的相互转化关系如图所示.
几种含硅元素的物质之间的相互转化关系如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:
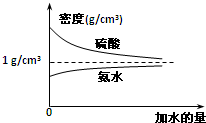 已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:
已知硫酸、氨水的密度与所加水量的关系如图所示,现有硫酸与氨水各一份,请根据表中信息,回答下列问题:| 溶液 | 溶质的物质的量浓度 | 溶液的密度/g?cm-3 |
| 硫酸 | 4mol?L-1 | ρ1 |
| 2mol?L-1 | ρ2 | |
| 氨水 | 4mol?L-1 | ρ3 |
| 2mol?L-1 | ρ4 |
查看答案和解析>>
科目:高中化学 来源: 题型:
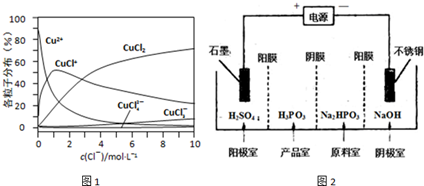
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、Ag+,K+,NO3-,Cl- |
| B、Na+,H+,NO3-,SO42- |
| C、K+,Ca2+,NO3-,CO32- |
| D、Cu2+,Ba2+,Cl-,SO42- |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com