
| A. | Na2CO3溶液加水稀释后,恢复至原温度,所有离子浓度均减小 | |
| B. | pH=5的CH3COOH溶液和pH=5的NH4Cl溶液中,c(H+)相等 | |
| C. | pH=12的Ba(OH)2溶液和pH=12的Na2CO3溶液中,水电离的c(H+)前者大 | |
| D. | 0.1mol•L-1CH3COONa溶液中:c(Na+)>c(CH3COO-)>c(H+)>c(OH-) |
分析 A.Na2CO3溶液加水稀释后,溶液浓度降低且溶液pH降低;
B.溶液中c(H+)=10-pH;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离;
D.醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,但钠离子不水解.
解答 解:A.Na2CO3溶液加水稀释后,溶液浓度降低且溶液pH降低,则溶液中c(H+)增大,故A错误;
B.溶液中c(H+)=10-pH,二者的pH相等,所以两种溶液中c(H+)相等,故B正确;
C.酸或碱抑制水电离,含有弱离子的盐促进水电离,氢氧化钡抑制水电离、碳酸钠促进水电离,所以水电离的c(H+)后者大,故C错误;
D.醋酸钠是强碱弱酸盐,醋酸根离子水解导致溶液呈碱性,则c(H+)<c(OH-),但钠离子不水解,醋酸根离子水解程度较小,所以溶液中离子浓度大小顺序是c(Na+)>c(CH3COO-)>c(OH-)>c(H+),故D错误;
故选B.
点评 本题考查弱电解质的电离及盐类水解,为高频考点,涉及离子浓度大小比较及对水电离影响等知识点,注意:酸或碱抑制水电离,含有弱离子的盐促进水电离,易错选项是A.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
| A. | 增大压强 | B. | 通入氦气 | C. | 增加Y的物质的量 | D. | 升高温度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 元素的性质随着相对原子质量的递增而呈周期性变化 | |
| B. | 两个原子如果核外电子排布相同,一定是同一种元素 | |
| C. | 原子的次外层电子数不一定是8个 | |
| D. | 一切原子的原子核都是由质子和中子构成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 两种物质的组成元素相同,各元素的质量分数也相同,则两者一定互为同分异构体 | |
| B. | 分子式为CnH2n的化合物,可能使酸性KMnO4溶液褪色,也可能不使其褪色 | |
| C. | 通式相同,分子组成上相差一个或若干个CH2原子团的化合物,一定互为同系物 | |
| D. | 凡含有苯环的物质都是芳香烃 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
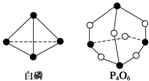 化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )
化学键的键能是形成(或断开)1mol化学键时释放(或吸收)的能量.已知白磷和P4O6的分子结构如图所示,现提供以下化学键的键能(kJ•mol-1):P-P:198 P-O:360 O═O:498若生成1mol P4O6,则反应P4(白磷)+3O2═P4O6中的能量变化为( )| A. | 吸收1 638 kJ能量 | B. | 放出1 638 kJ能量 | ||
| C. | 吸收126 kJ能量 | D. | 放出126 kJ能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

| 加入的试剂 | H2的体积(相同条件下) | 反应时间 | 反应速率 |
| 1mol/L硫酸溶液 | 10mL | t1 | v1 |
| 4mol/L硫酸溶液 | 10mL | t2 | v2 |
| 时间(min) | 0 | 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| 硫酸浓度(mol/L) | 4.0 | 3.8 | 3.5 | 3.1 | 2.6 | 2.2 | 1.9 | 1.8 | … |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com