
| A. | 由非金属元素组成的化合物不一定都是共价化合物 | |
| B. | 共价化合物中一定含有极性键 | |
| C. | 含有离子键的化合物一定是离子化合物 | |
| D. | 所有气体单质分子中一定含有非极性键 |
分析 原子间以共用电子对形成化学键,属于共价键,不同非金属原子间形成极性键,相同非金属原子间形成非极性键;共价化合物中只含有共价键,离子化合物中一定含有离子键,可能含有共价键,以此解答该题.
解答 解:A.由非金属元素形成的化合物可能是离子化合物,如铵盐,故A正确;
B.化合物中至少含有2种元素,则共价化合物中一定含有极性键,故B正确;
C.含有离子键的化合物属于离子化合物,离子化合物中可能含有共价键,如NaOH,故C正确;
D.稀有气体分子属于单原子分子,分子中没有共价键,故D错误.
故选D.
点评 本题考查化学键及化合物的类别,熟悉化学键的形成及特殊物质中的化学键即可解答,注意利用实例来分析解答.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 将25℃1mL pH=3的HA溶液加水稀释至100mL,稀释后溶液的PH=4 | |
| B. | HA溶液与NaHCO3溶液反应放出CO2 | |
| C. | 25℃时,NaA溶液的pH大于7 | |
| D. | 往HA溶液中滴入甲基橙,溶液呈橙色,不呈红色 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2SO4和H2SO3 | B. | (HO)2RO2和(HO)2RO3 | C. | HNO3和HNO2 | D. | HClO4和H2SiO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
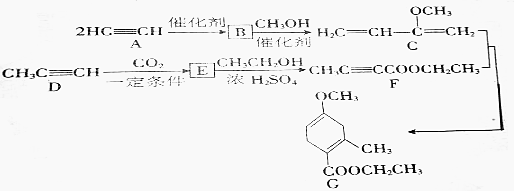
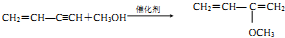 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
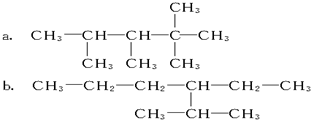
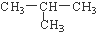 与 CH3-CH2-CH2-CH3 ⑧14N与14C.
与 CH3-CH2-CH2-CH3 ⑧14N与14C.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com