
(本小题16分)高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。某研究小组设计了用工业废铁屑(含铜、碳、硅等)制取高铁酸钠的工艺流程,其中X、Y、Z是含铁化合物。
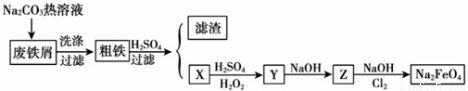
(1)废铁屑中加入碳酸钠热溶液的目的__________________________________。
(2)试写出上述过程中X转 化 为Y的离子方程式_____________________________________。
(3)写出Cl2将Z氧化为Na2Fe O 4的化学方程式________________________________。
(4)高铁酸钠消毒后的还原产物具有净水作用,解释净水原理_____________________________。
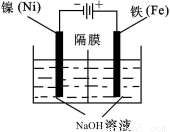
(5)电化学法制备高铁酸钠采用铁片作阳极,浓NaOH溶液作为电解质溶液(如下图所示),试写出阳极的电极反应式: ;总电解反应离子方程式为_____ 。电解一段时间后,收集到某种气体标况下为3.36L,则获得高铁酸钠的物质的量为 ,阳极区周围溶液的pH________(填“升高”、“降低”或“不变”)。
(本小题16分,每空2分)(1)清洗废铁屑表面的油污;
(2)2Fe2+ + H2O2 + 2H+ ==2Fe3+ + 2H2O
(3)10NaOH + 3Cl2 + 2Fe(OH)3 = 2Na2FeO4 + 6NaCl + 8H2O
(4)高铁酸盐在杀菌消毒时,本身被还原成Fe3+,Fe3+易水解生成Fe(OH)3胶体,可吸附水中的悬浮杂质,而起到净化水的作用。
(5)Fe-6e-+8OH-=FeO42-+4H2O ;Fe+2OH-+2H2O 电解 FeO42-+3H2↑; 0.05mol ;降低。
【解析】
试题分析:由于碳酸钠是强碱弱酸盐,在溶液中发生水解反应产生OH-,使溶液显碱性,盐的水解反应是吸热反应,升高温度会促进盐的水解,而油脂在碱性条件下发生水解反应产生可溶性的物质,因此废铁屑中加入碳酸钠热溶液的目的是清洗废铁屑表面的油污;(2)根据图示可知X是FeSO4,试写出上述过程中X转 化 为Y的离子方程式向该溶液中加入H2SO4和H2O2,在酸性条件下,H2O2将FeSO4氧化为Fe2(SO4)3;X转 化 为Y的离子方程式是2Fe2+ + H2O2 + 2H+ ==2Fe3+ + 2H2O ;Fe2(SO4)3与NaOH发生反应形成Fe(OH)3沉淀,在碱性条件下Fe(OH)3被Cl2氧化为Na2Fe O 4,根据电子守恒和质量守恒定律可得该反应的方程式是:10NaOH + 3Cl2 + 2Fe(OH)3 = 2Na2FeO4 + 6NaCl + 8H2O ;(4)高铁酸钠有强氧化性,它消毒后的还原产物Fe3+易水解生成Fe(OH)3胶体,可吸附水中的悬浮杂质,而起到净化水的作用。 (5)电化学法制备高铁酸钠采用铁片作阳极,浓NaOH溶液作为电解质溶液在阳极Fe失去电子,在碱性条件下被氧化为FeO42-,阳极的电极反应式Fe-6e-+8OH-=FeO42-+4H2O ;总电解反应离子方程式为Fe+2OH-+2H2O 电解 FeO42-+3H2↑根据总方程式可知产生的气体是H2。n(H2)= 3.36L÷22.4L/mol=0.15mol;根据电子守恒可得n(FeO42-)= n(H2)/3=0.05mol;阳极区周围溶液的由于OH-不断被消耗,c(OH-)降低,所以溶液的pH降低。
考点:考查高铁酸钠的制取方法、反应原理、作用、离子方程式和电极反应式的书写及相应计算的知识。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2015届北京市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列物质的使用不涉及化学变化的是
A.用活性炭去除冰箱中的异味
B.用热碱水清除炊具上残留的油污
C.用浸泡过高锰酸钾溶液的硅藻土保鲜水果
D.用含硅胶、铁粉的透气小袋与食品一起密封包装
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
常温下,下列溶液中的粒子浓度关系正确的是
A.NH4Cl溶液中:c(Cl-)=c(NH4+) >c(OH-)=c(H+)
B.Na2SO4溶液中:c(Na+)+ c(H+)=c(SO42-) + c(OH-)
C.NaHCO3溶液中:c(Na+)>c(HCO3-)>c(CO32-)>c(OH-)
D.浓度均为0.1mol·L-1CH3COOH与CH3COONa溶液等体积混合:2c(H+)-2c(OH-)=c (CH3COO-)-c(CH3COOH)
查看答案和解析>>
科目:高中化学 来源:2015届北京市朝阳区高三年级第一学期期中统一考试化学试卷(解析版) 题型:选择题
下列说法正确的是
A.化合反应一定是放热反应
B.乙二醇和丙三醇都易溶于水和乙醇
C.牺牲阳极的阴极保护法是利用了电解原理
D.相同条件下,CuSO4溶液比FeCl3溶液使H2O2分解速率更快
查看答案和解析>>
科目:高中化学 来源:2015届北京市东城区普通校高三11月联考化学试卷(解析版) 题型:选择题
某未知溶液中已检验出含有离子Ca2+、NO3-,且pH=2。欲检验此溶液中是否大量存在以下6种离子:①ClO- ②NH4+ ③I- ④Fe2+ ⑤AlO2- ⑥Cl-,其中不必检验就能排除的离子是
A.②③⑤⑥ B.①③④⑤
C.①④⑤⑥ D.①②③④
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:选择题
铝是一种很重要的金属,可以发生一系列反应制备物质。

下列说法错误的是
A.反应①又称铝热反应,曾用于野外焊接铁轨
B.利用反应②③都能产生氢气,且产生等量氢气消耗Al的质量和转移电子数分别相等
C.反应①②中铝均作还原剂
D.常用反应⑥制备Al(OH)3,方法是向Al2(SO4)3溶液中滴加NaOH溶液至恰好完全沉淀
查看答案和解析>>
科目:高中化学 来源:2015届北京十中高三第一学期期中化学试卷(解析版) 题型:选择题
对可逆反应4NH3(g)+ 5O2(g) 4NO(g)+ 6H2O(g),下列叙述正确的是
4NO(g)+ 6H2O(g),下列叙述正确的是
A.达到化学平衡时,4υ正(O2)= 5υ逆(NO )
B.若单位时间内生成x mol NO的同时,消耗x mol NH3 ,则反应达到平衡状态
C.达到化学平衡时,若增加容器体积,则正反应速率增大,逆反应速率减少
D.化学反应速率关系是:2υ正(NH3)= 3υ正(H2O)
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古赤峰市高三上学期9月质量检测化学试卷(解析版) 题型:选择题
短周期主族元素X、Y、Z、W在元素周期表中的位置关系如图,下列推论合理的是

A.若Z的核电荷数是Y的两倍,则X为碳元素
B.若W的核电荷数是Y的两倍,则X是氮元素
C.原子半径:Z>Y>X
D.最简单氢化物的稳定性:Y>X>W
查看答案和解析>>
科目:高中化学 来源:2015届内蒙古巴彦淖尔市高三10月月考化学试卷(解析版) 题型:选择题
下列现象或事实可用同一原理解释的是
A.浓硫酸和浓盐酸长期暴露在空气中浓度降低
B.铁在冷的浓硫酸中和铝在冷的浓硝酸中都没有明显变化
C.SO2、漂白粉、活性炭、过氧化钠都能使红墨水褪色
D.漂白粉和水玻璃长期暴露在空气中变质
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com