
【题目】下列说法正确的是
A.反应2CO(g)+O2(g)=2CO2(g)在一定条件下能自发进行的原因是ΔS>0
B.由Ksp[Mg(OH)2]=1.8×10-11可知常温下pH=8的溶液中,c(Mg2+)≤1.8×10-5mol·L1
C.反应H2(g)+Cl2(g)=2HCl(g)的ΔH可用下式换算:ΔH=反应中断裂的旧化学键键能之和-反应中形成的新化学键键能之和
D.由反应C(s)+1/2O2 (g)=CO(g)ΔH=-111 kJ·mol1可知C的燃烧热是111 kJ·mol1
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A. 0.3 mol Cu与足量稀硝酸充分反应,可收集到4.48L气体
B. 由NO2和N2O4组成的混合物46g中共含有2NA个N原子
C. 常温常压下,16g甲烷分子中所含质子数为10NA
D. 0.2mol/L的NH4NO3溶液中所含N原子的数目为0.4NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,1L 1mol/LHF溶液中含HF分子数目为NA
B.2CO2(g)+6H2(g) ![]() CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量
CH3CH2OH(g)+3H2O(g) △H=-a kJ·mol-1,将2mol CO2和6mol H2在一密闭容器中按照上述反应充分反应放出a kJ的热量
C.78gNa2O2固体中含阴离子数目为NA
D.25g质量分数68%的H2O2水溶液中含氧原子数目为NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学学习中常用类推方法,下列类推正确的是( )
A. 离子晶体NH4Cl的所有原子的最外层均满足2个或8个电子的稳定结构,离子晶体NH4H的所有原子的最外层电子均满足2个或8个电子的稳定结构
B. 固态CO2是分子晶体,固态SiO2也是分子晶体
C. NCl3中N原子是sp3杂化,BCl3中B原子也是sp3杂化
D. 已知Be与Al的化学性质相似,Al(OH)3、Be(OH)2都能与NaOH溶液反应,且生成的盐都可用NaXO2表示(X表示Al或Be)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,不能表明反应:A(s)+2B(g)![]() C(g)+D(g)已达平衡的是( )
C(g)+D(g)已达平衡的是( )
A.混合气体的压强B.混合气体的密度
C.B的物质的量浓度D.混合气体的平均相对分子质量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】很多非金属元素是地球上组成生命的基本元素,特别是碳元素、氧元素与其它元素结合成不计其数的无机物和有机化合物,构成了丰富多彩的世界。请回答下列问题:
(1)基态碳原子最外层有______种空间运动状态不同的电子,其价电子排布图(即价电子轨道表示式)为______。
(2)写出COS的电子式:_______,中心原子的杂化轨道类型为_______杂化,写出与COS互为等电子体的粒子化学式(分子与离子各一种):________、_______。
(3)碳酸盐在一定温度下会发生分解,实验证明碳酸盐的阳离子不同,分解温度不同,如下表所示:
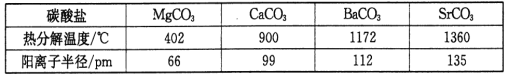
试从生成物角度分析为什么随着阳离子半径的增大,碳酸盐的分解温度逐步升高?___________。
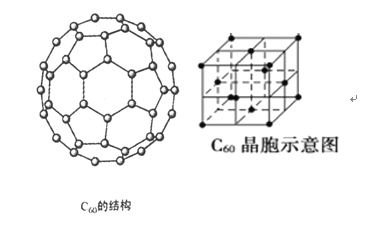
(4)碳的一种同素异形体—C60,又名足球烯,是一种高度对称的球碳分子(C60分子结构和C60晶体的晶胞结构如下图所示)。立方烷(分子式:C8H8,结构是立方体:![]() )是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体中组成的C8H8与C60分子个数比为__________。
)是比C60约早20年合成出的一种对称型烃类分子,而现如今已合成出一种立方烷与C60的复合型分子晶体,立方烷分子填充在原C60晶体的分子间空隙中。则该复合型分子晶体中组成的C8H8与C60分子个数比为__________。
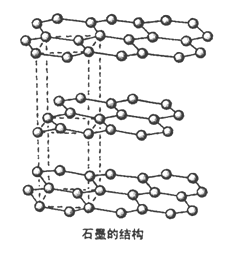
(5)碳的另一种同素异形体——石墨,其晶体结构如图所示,虚线勾勒出的是其晶胞。则石墨晶胞含碳原子个数为________个。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】J、M、Q、R、T、X、Y、Z为前四周期原子序数依次增大的8种元素(不包含0族元素)。J的原子半径是周期表所有元素中最小的,M基态原子的3个能级所含电子数相同,R的基态原子2p能级上未成对电子数与M相同,T的基态原子含13种运动状态不同的电子,X与R位于同一主族,Y的基态原子最外层有7个电子,Z的基态原子最外层电子数是次外层的1/7。(回答问题时用字母对应的元素符号)
⑴基态Z2+的核外电子排布式是______。
⑵Q、R、X的第一电离能由大到小的顺序是______。
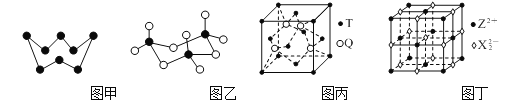
⑶X8的结构如图甲所示,其熔沸点均高于XR2,原因是______。
⑷气态XR3以单分子形式存在,其分子的立体构型为______;固体XR3中存在如图乙所示的三聚分子,该分子中X原子的杂化轨道类型为______。
⑸不考虑配离子[T(RJ)4]-的空间构型, [T(RJ)4]-的结构式可以表示为______。(用“→”表示其中的配位键)
⑹由T、Q原子形成的晶体晶胞如图丙所示,相邻T、Q原子间以共价键相连接。该晶体的化学式为______,预测该晶体熔点高或低,并说明理由:_____。
⑺ZX2晶体的晶胞如图丁所示,距离每个Z2+最近的Z2+的个数是______。
⑻JY易溶于水的原因是______。
⑼1 mol MR(QJ2)2中所含σ键的数目是______。
⑽MQR-的中心原子的轨道杂化类型是______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应:2NO(g) + O2(g)![]() 2NO2(g) △H<0达平衡后,若分别采取下列措施;①增大压强 ② 减小NO2的浓度 ③增大O2浓度、④升高温度 ⑤加入催化剂,能使平衡向正向移动的是
2NO2(g) △H<0达平衡后,若分别采取下列措施;①增大压强 ② 减小NO2的浓度 ③增大O2浓度、④升高温度 ⑤加入催化剂,能使平衡向正向移动的是
A.①②③B.②③④C.③④⑤D.①②⑤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g) ![]() FeO(s)+CO(g);△H>0
FeO(s)+CO(g);△H>0
(1)一定温度下,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如右图所示,则8分钟内CO的平均反应速率v(CO)=______。
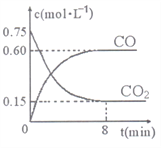
(2)写出该反应平衡常表达式:K=__________;下列措施中能使该反应的平衡常数K增大的是____(填序号)。
A.升高温度 B.增大压强 C.充入CO D.再加入一些铁粉
(3)反应达到平衡后,若保持容器体积不变时,再通入少量的CO2,则CO2的转化率将______ (填“增大”、“减小”、“不变”)。
(4)铁的重要化合物在生产生活中应用十分广泛。
①高铁酸钠(Na2FeO4)是一种新型饮用水消毒剂。高铁酸钠生产方法之一是:强碱性溶液中用NaClO氧化Fe(OH)3生成高铁酸钠、氯化钠和另一种常见化合物,该反应的离子方程式为____________。
②高铁电池的总反应为:3Zn+2K2FeO4+8H2O![]() 3Zn(OH)2+2Fe(OH)3+4KOH
3Zn(OH)2+2Fe(OH)3+4KOH
下列叙述错误的是____(填序号)。
A.放电时每转移6mol电子,负极有2mol K2FeO4被还原
B.充电时阴极反应为:Zn(OH)2 +2e-=Zn+ 2OH-
C.放电时正极反应为:FeO42-+ 3e-+ 4H2O= Fe(OH)3+ 5OH-
D.充电时阳极附近溶液的碱性减弱
(5)已知:2CO(g)+O2(g)= 2CO2(g) △H=-566 kJ/mol
2H2(g)+ O2(g)= 2H2O(g);△H=-483.6 kJ/mol
写出CO和H2O(g)作用生成CO2和H2的热化学方程式:____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com