
分析 (1)由于题中强调足量的草酸,故反应后草酸转化为HC2O4-,HCO3-转化为CO2;
(2)由紫红色褪去可知草酸具有还原性,把MnO4-还原为Mn2+,根据氧化还原反应得失电子守恒配平反应方程式;
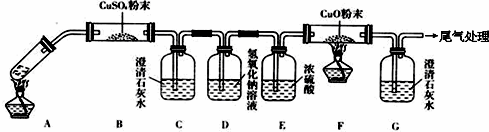
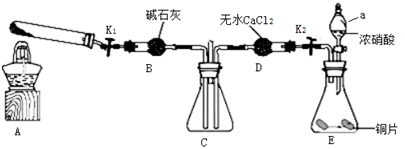
(3)乙二酸分解的化学方程式为H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑,由各物质的性质可推测B中CuSO4固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除去CO2,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成;G中澄清石灰水变浑浊,不能说明草酸分解产物中一定有CO,D装置后缺少装置检验CO2是否除尽;
(4)2.52g草酸晶体(H2C2O4•2H2O)的物质的量为$\frac{2.52g}{126g/mol}$=0.02mol,100mL 0.2mol/L的NaOH的物质的量为0.1L×0.2mol/L=0.02mol,两者正好1:1反应生成NaHC2O4,溶液显酸性说明HC2O4-的电离程度大于其水解程度,结合守恒关系可得离子浓度间的大小关系.
解答 解:(1)乙二酸足量,反应后草酸转化为HC2O4-,HCO3-转化为CO2,反应的离子方程式为:HCO3-+H2C2O4=HC2O4-+CO2↑+H2O,
故答案为:HCO3-+H2C2O4=HC2O4-+CO2↑+H2O;
(2)向盛有乙二酸饱和溶液的试管中滴入几滴硫酸酸化的KMnO4溶液,振荡,发现其溶液的紫红色褪去,说明具有氧化性的高锰酸钾被还原,说明草酸具有还原性,把MnO4-还原为Mn2+,草酸被氧化成CO2,根据氧化剂得失电子守恒可知氧化剂和还原剂物质的量之间的关系为:2MnO4-~5H2C2O4,在根据电荷守恒和质量守恒可写出反应方程式为:2MnO4-+5H2C2O4+6H+=2Mn2++10CO2↑+8H2O;
故答案为:还原性;2;5;6;2;10;8;
(3)根据题意知乙二酸分解的化学方程式为H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑,由各物质的性质可推测B中CuSO4固体检验草酸分解产物中的水,C装置检验草酸分解产物中的CO2,D装置的目的是为了除去CO2,但,E装置用来干燥气体,F、G装置用来判断草酸分解产物中有无CO生成;G中澄清石灰水变浑浊,不能说明草酸分解产物中一定有CO,D装置后缺少装置检验CO2是否除尽,应在在D、E之间增加一个装有澄清石灰水的洗气瓶检验CO2是否除尽;
故答案为:除去混合气体中的CO2;H2C2O4$\frac{\underline{\;\;△\;\;}}{\;}$H2O+CO↑+CO2↑;不能;在D、E之间增加一个装有澄清石灰水的洗气瓶
(4)2.52g草酸晶体(H2C2O4•2H2O)的物质的量为$\frac{2.52g}{126g/mol}$=0.02mol,100mL 0.2mol/L的NaOH的物质的量为0.1L×0.2mol/L=0.02mol,两者正好1:1反应生成NaHC2O4,其浓度为0.2mol/L;
A.电荷不守恒,正确的应为:c(Na+)+c(H+)═c(HC2O4-)+c(OH-)+2c(C2O42-),故A错误;
B.物料不守恒,正确的应为:c(H2C2O4)+c(HC2O4-)+c(C2O42-)=c(Na+)=0.2mol•L-1,故B错误;
C.溶液显酸性说明HC2O4-的电离程度大于其水解程度(程度都较小),则有c(HC2O4-)>c(C2O42-)>c(H2C2O4)故C正确;
D.根据物料守恒可知c(Na+)=c(H2C2O4)+c(HC2O4-)+c(C2O42-),故D正确;
故选CD.
点评 本题主要考查了草酸的性质,涉及离子方程式书写、微粒浓度比较、氧化还原反应等,综合性较强,掌握实验的原理是解题的关键,(1)为易错点,学生容易忽略草酸过量问题,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
 甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )
甲~庚等元素在周期表中的相对位置如下表,己的最高氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数.下列判断正确的是( )| A. | 丙与戊的原子序数相差26 | |
| B. | 气态氢化物的稳定性:庚<己<戊 | |
| C. | 常温下,甲和乙的单质均能与水剧烈反应 | |
| D. | 丁的最高价氧化物可用于制造光导纤维 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
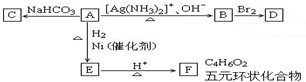 根据图示填空:(已知A分子式为${C_4}H_4^{\;}{O_3}$)
根据图示填空:(已知A分子式为${C_4}H_4^{\;}{O_3}$)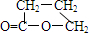 +H2O
+H2O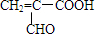
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1:4 | B. | 1:3 | C. | 1:1 | D. | 4:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有机玻璃受热软化,易于加工成型,是一种硅酸盐材料 | |
| B. | 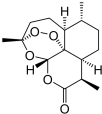 世界卫生组织认为青蒿素(结构如图所示)联合疗法是当下治疗疟疾最有效的手段,烃类物质青蒿素已经拯救了上百万生命 | |
| C. | 纯银器在空气中久置变黑是因为发生了电化学腐蚀 | |
| D. | 硫酸亚铁片和维生素C同时服用,能增强治疗缺铁性贫血的效果 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 10gH2和10gCO | B. | 11.2LCO(标准状况)和22gCO2 | ||
| C. | 18gH2O和44gCO2 | D. | 22.4LH2和0.1molN2 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com