
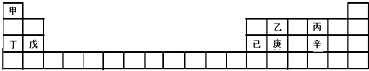
| A. | 甲、丁、戊的单质都是金属 | |
| B. | 乙、丙、辛都是非金属元素 | |
| C. | 乙、庚、辛都能形成氧化物 | |
| D. | 已的氧化物既可溶于KOH溶液又可溶于H2SO4溶液 |
分析 由元素在周期表的位置可知,甲为H,乙为C,丙为O,丁为Na,戊为Mg,已为Al,庚为Si,辛为S,然后结合元素的单质、化合物性质来解答.
解答 解:由元素在周期表的位置可知,甲为H,乙为C,丙为O,丁为Na,戊为Mg,已为Al,庚为Si,辛为S,
A.丁、戊的单质都是金属,而甲不是,故A错误;
B.乙、丙、辛分别为C、O、S,都是非金属元素,故B正确;
C.乙、庚、辛都能形成氧化物,如CO、CO2、SiO2、SO2、SO3,故C正确;
D.已的氧化物为氧化铝,属于两性氧化性,既可溶于KOH溶液又可溶于H2SO4溶液,故D正确;
故选A.
点评 本题考查位置、结构与性质的关系,为高频考点,把握元素的位置、元素的性质、元素化合物知识为解答的关键,侧重分析与应用能力的考查,注意氧化铝为两性氧化物,题目难度不大.


 新课标同步训练系列答案
新课标同步训练系列答案 一线名师口算应用题天天练一本全系列答案
一线名师口算应用题天天练一本全系列答案科目:高中化学 来源: 题型:实验题
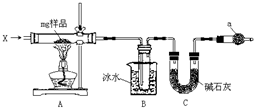 为确定碳酸钠和碳酸氢钠混合样品中碳酸氢钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如图:
为确定碳酸钠和碳酸氢钠混合样品中碳酸氢钠的质量分数,可通过加热分解得到的CO2质量进行计算,某同学设计的实验装置示意图如图:查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 步骤一:取少量制品于试管中,加少量蒸馏水,振荡,溶解.往试管中加入过量的Ba(NO3)2溶液 振荡,观察; | 现象:溶液中产生大量白色沉淀; 结论:试样中含有Na2CO3. |
| 步骤二:将步骤一的浊液过滤,取滤液于试管中B中,加入适量的NaOH溶液, 振荡,观察; | 现象:有少量白色沉淀生成; 结论:样品中含有NaHCO3. |
| 步骤三:将步骤二的浊液过滤,取滤液于试管C中,先加入足量的稀硝酸 再加入少许AgNO3溶液振荡,观察. | 现象:有少量白色沉淀生成; 结论:试样中含有NaCl. |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| Zn的质量 | H2SO4的浓度 | 收集20mL H2所需的时间 | |
| ① | 10g(锌粒) | 0.1mol/L | 153s |
| ② | 10g(锌粉) | 0.1mol/L | 125s |
| ③ | 10g(锌粉) | 0.2mol/L | 62s |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
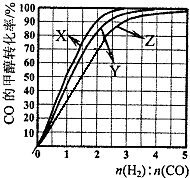 甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1
甲醇是新型的汽车动力燃料.工业上可通过CO和H2化合制备甲醇,该反应的热化学方程式为:CO (g)+2H2(g)?CH3OH (g)△H1=-116kJ•mol-1查看答案和解析>>
科目:高中化学 来源: 题型:推断题
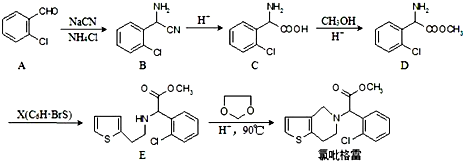
 ,
, ;
;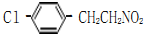 、
、 、
、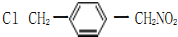
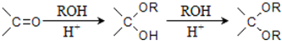
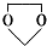 的合成路线流程图(无机试剂任选).
的合成路线流程图(无机试剂任选).查看答案和解析>>
科目:高中化学 来源: 题型:推断题
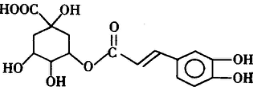
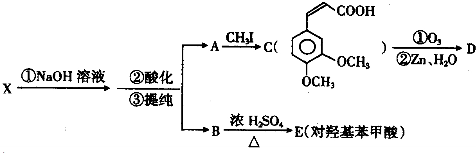
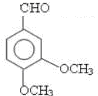 ;
;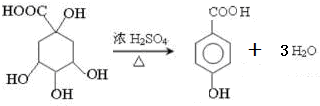 ;
;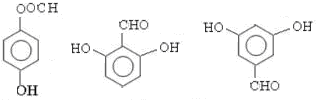 任意一种(任写一种)
任意一种(任写一种)查看答案和解析>>
科目:高中化学 来源: 题型:实验题
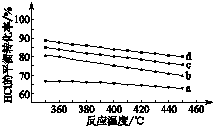 用Cl2生产含氯有机物时会产生HCl.利用反应4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)可实现氯的循环利用.
用Cl2生产含氯有机物时会产生HCl.利用反应4HCl(g)+O2(g)?2Cl2(g)+2H2O(g)可实现氯的循环利用.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com