
分析 (1)硫酸和氢氧化钠溶液反应生成硫酸钠和水,反应实质为氢离子与氢氧根离子反应生成水;
(2)硫酸和氢氧化钡溶液反应生成硫酸钡沉淀和水;
(3)氢氧化铁和盐酸反应生成氯化铁和水,离子方程式中氢氧化铁不能拆开;
(4)氨水和盐酸反应生成氯化铵和水,一水合氨不能拆开,需要保留分子式.
解答 解:(1)硫酸中和氢氧化钠反应实质是氢离子和氢氧根离子反应,其反应的离子方程式为:OH-+H+=H2O,故答案为:OH-+H+=H2O;
(2)氢氧化钡与稀硫酸反应生成硫酸钡和水,反应的离子方程为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O,故答案为:Ba2++2OH-+2H++SO42-=BaSO4↓+2H2O;
(3)氢氧化铁和盐酸反应生成氯化铁和水,反应的离子方程式为:Fe(OH)3+3H+=Fe3++3H2O,故答案为:Fe(OH)3+3H+=Fe3++3H2O;
(4)氨水和盐酸反应生成氯化铵和水,反应的离子方程式为:NH3•H2O+H+=H2O+NH4+,故答案网为:NH3•H2O+H+=H2O+NH4+.
点评 本题考查了离子方程式的书写,题目难度中等,注意掌握离子方程式的概念、表示意义及书写原则,把握需要保留化学式的物质,如难溶物、弱电解质、氧化物,还要明确离子方程式满足守恒关系如:质量守恒定律、电荷守恒、电子守恒.


 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案科目:高中化学 来源: 题型:选择题
| A. | 溶液是电中性的,胶体则是带电的 | |
| B. | 次氯酸具有强氧化性,属于强电解质 | |
| C. | 铜在氯气中燃烧产生棕色的烟,产物的稀溶液为蓝色 | |
| D. | 铁与稀硝酸充分反应后铁没有剩余,则溶液中一定有Fe3+ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
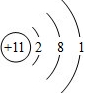 ,YX3的电子式为
,YX3的电子式为 (用元素符号表示).
(用元素符号表示).查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 通入X溶液浑浊,通入Y无明显现象 | B. | 通入X现象不明显,通入Y溶液浑浊 | ||
| C. | 通入X和Y溶液均无明显现象 | D. | 通入X和Y溶液均浑浊 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 下表为某市售盐酸试剂瓶标签上的部分信息:
下表为某市售盐酸试剂瓶标签上的部分信息:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 28g氮气含有的原子数为NA | |
| B. | 4g金属钙的物质的量为1mol | |
| C. | 1mol O2分子的质量等于1mol氧原子的质量 | |
| D. | 24g O2分子和24g O3分子所含的氧原子数相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若pH>7,则一定是c1V1≥c2V2 | |
| B. | 在任何情况下都是c(Na+)+c(H+)═c(CH3COO-)+c(OH-) | |
| C. | 当醋酸和氢氧化钠溶液恰好完全反应后,滴加酚酞溶液,颜色变红 | |
| D. | 反应的离子方程式为:H++OH-═H20 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
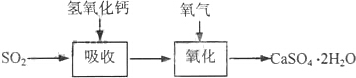
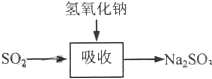
| 试剂 | Ca(OH)2 | NaOH |
| 价格(元/kg) | 0.36 | 2.9 |
| 吸收SO2的成本(元/mol) | 0.027 | 0.232 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com