
分析 (1)①钠元素有氧化钠、过氧化钠,铝元素只有氧化铝,铁元素有氧化亚铁、氧化铁、四氧化三铁等;氧化钠、氧化亚铁、氧化铁属于碱性氧化物;
②2.3g Na物质的量n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,与O2完全反应生成3.6g产物,依据钠元素守恒计算若生成氧化钠质量为0.05mo×62g/mol=3.1g,若生成过氧化钠质量=0.05mol×78g/mol=3.9g,则生成产物为氧化钠和过氧化钠,依据全部反应的钠计算电子转移;
③硫酸铝与氨水反应生成硫酸铝与氢氧化铝沉淀,氢氧化铝具有弱碱性,与盐酸反应生成氯化铝与水,可以治疗胃酸过多;
④把金属铁加入到氯化铁、氯化亚铁和氯化铜的混合溶液中,发生2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,剩余固体中有铜无铁,则与Cu反应的离子一定不存在,以此解答该题.
⑤铝与氧化铁发生反应生成Fe与氧化铝,根据方程式计算生成1molFe需要Al的物质的量,再根据m=nM计算;
(2)根据n=$\frac{m}{M}$计算二氧化硅的物质的量,根据电子转移守恒计算n(CO),再根据V=nVm计算CO的体积.
解答 解:(1)①钠元素有氧化钠、过氧化钠,铝元素只有氧化铝,铁元素有氧化亚铁、氧化铁、四氧化三铁等,Fe元素所形成氧化物种类最多;氧化钠、氧化亚铁、氧化铁属于碱性氧化物,故答案为:铁;3;
②2.3g Na物质的量n(Na)=$\frac{2.3g}{23g/mol}$=0.1mol,与O2完全反应生成3.6g产物,依据钠元素守恒计算若生成氧化钠质量为0.05mo×62g/mol=3.1g,若生成过氧化钠质量=0.05mol×78g/mol=3.9g,则生成产物为氧化钠和过氧化钠,依据全部反应的钠计算电子转移数=0.1mol×NA=0.1NA,
故答案为:0.1NA;
③硫酸铝与氨水反应生成硫酸铝与氢氧化铝沉淀,反应离子方程式为Al3++3NH3.H2O=Al(OH)3↓+3NH4+,
氢氧化铝具有弱碱性,与盐酸反应生成氯化铝与水,反应离子方程式为Al(OH)3+3H+=Al3++3H2O,可以治疗胃酸过多,
故答案为:Al3++3NH3.H2O=Al(OH)3↓+3NH4+;Al(OH)3+3H+=Al3++3H2O;
④把金属铁加入到氯化铁、氯化亚铁和氯化铜的混合溶液中,发生2Fe3++Fe=3Fe2+,Fe+Cu2+=Fe2++Cu,剩余固体中有铜无铁,则与Cu反应的离子一定不存在,Fe3+完全反应,一定没有,溶液中一定含有阳离子为Fe2+,可能含有Cu2+完全反应,
故答案为:Fe2+;Cu2+;Fe3+;
⑤铝与氧化铁发生反应生成Fe与氧化铝,反应方程式为2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe,根据方程式可知生成1molFe需要Al的物质的量为1mol,需要Al的质量=1mol×27g/mol=27g,
故答案为:2Al+Fe2O3$\frac{\underline{\;高温\;}}{\;}$Al2O3+2Fe;27;
(2)60g二氧化硅的物质的量=$\frac{30g}{60g/mol}$=0.5mol,根据电子转移守恒可知n(CO)=$\frac{0.5mol×4}{2}$=1mol,故生成CO的体积=1mol×22.4L/mol=22.4L,
故答案为:22.4L.
点评 本题考查常见计算单质及化合物的性质与用途、常用化学用语、离子判断、化学计算等,题目难度中等,注意基础知识的积累掌握.


科目:高中化学 来源: 题型:解答题
 第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.
第21届联合国气候大会于2015年11月30日在巴黎召开,会议的主题是减 少温室气体排放量.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 150mL 1mol•L-1NaCl溶液 | B. | 75mL 1mol•L-1 CaCl2溶液 | ||
| C. | 150mL 1mol•L-1 KCl溶液 | D. | 75mL 1mol•L-1 AlCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 与铝反应产生大量氢气的溶液:Na+、K+、CO32-、NO3- | |
| B. | 0.1mol•L-1的NaOH溶液:K+、Na+、SO42-、CO32- | |
| C. | 0.1mol•L-1FeCl3溶液:K+、NH4+、SO42-、SCN- | |
| D. | 使紫色石蕊试液变红的溶液:Ca2+、Na+、ClO-、NO3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | pH=4的NaHSO3溶液中:c(Na+)>c(H+)>c(HSO3-)>c(SO32-)>C(OH-) | |
| B. | 0.2mol•L-1Na2CO3溶液和0.1mol•L-1盐酸等体积混合,在混合溶液中:c(Na+)>c(CO32-)>c(HCO3-)>c(OH-)>c(H+) | |
| C. | 等体积、等浓度的HR溶液和NaOH溶液混合,溶液中一定存在:c(Na+)>c(R-)>c(OH-)>c(H+) | |
| D. | 等体积、等浓度的①CH3COONa②NaNO3③NaClO溶液中离子总数:②>①>③ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
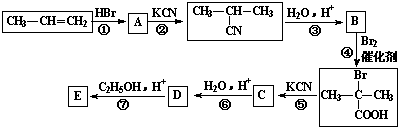
 ;
;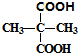 +2C2H5OH$?_{△}^{浓硫酸}$
+2C2H5OH$?_{△}^{浓硫酸}$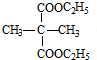 +2H2O.
+2H2O.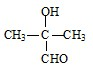 、
、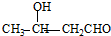 .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 元素代号 | X | Y | Z | W |
| 原子半径/pm | 160 | 143 | 70 | 66 |
| 主要化合价 | +2 | +3 | -3、+5 | -2 |
| A. | X、Y元素的金属性:X<Y | |
| B. | 一定条件下,Z单质与W的常见单质直接生成ZW2 | |
| C. | Y的最高价氧化物对应的水化物能溶于稀氨水 | |
| D. | 一定条件下,W单质可以和Z的氢化物反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com