
【题目】下列元素原子半径最接近的一组是( )
A.Ne、Ar、Kr、Xe B.Mg、Cu、Sr、Ba
C.B、C、N、O D.Cr、Mn、Fe、Co
科目:高中化学 来源: 题型:
【题目】氮的氧化物种类较多,有N2O、NO、N2O3、NO2、N2O4、N2O5等,它们应用广泛。
(1)N2O是人类最早应用于医疗的麻醉剂之一。它可由NH4NO3在加热条件下分解产生,此反应的化学方程式为______________________________。
(2)N2O4可作火箭高能燃料N2H4的氧化剂。已知:2NO2(g)![]() N2O4(g)△H=﹣akJmol﹣1;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJmol﹣1;N2(g)+2O2(g)=2NO2(g)△H=+ckJmol﹣1;(a、b、c均大于0)。写出气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式________。
N2O4(g)△H=﹣akJmol﹣1;N2H4(g)+O2(g)=N2(g)+2H2O(g)△H=﹣bkJmol﹣1;N2(g)+2O2(g)=2NO2(g)△H=+ckJmol﹣1;(a、b、c均大于0)。写出气态肼(N2H4)在气态(N2O4)中燃烧生成氮气和气态水的热化学方程式________。
(3)平衡常数K可用反应体系中气体物质分压表示,即K表达式中用平衡分压代替平衡浓度,分压=总压 × 物质的量分数[例如p(NO2)=p总×x(NO2)]。则反应2NO2(g)N2O4(g)△H=﹣akJmol﹣1平衡常数Kp表达式为______(用p总、和各气体物质的量分数x表示)。
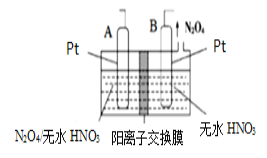
(4)新型绿色硝化剂N2O5可以通过N2O4为原料用电解法制备,实验装置如图所示。则电极B接直流电源的___极,电解池中生成N2O5的电极反应式为______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电子工业中,常用FeCl3溶液腐蚀绝缘板上的铜箔,制造印刷电路板。某同学为了从腐蚀废液中回收铜,并重新获得FeCl3溶液,设计如下流程图
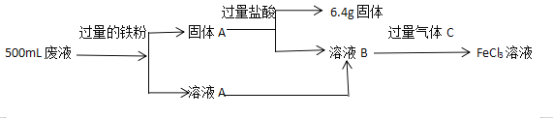
请回答下列问题:
(1)FeCl3溶液腐蚀铜箔反应的离子方程式为___________。
(2)固体A的成分是_______,气体C的化学式为____________。
(3)设计实验方案证明FeCl3溶液中的金属阳离子_____________。
(4)反应消耗铁粉11.2g,则废液中Fe3+的物质的量浓度是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】云阳龙缸云端廊桥曾被詟为“世界第一悬挑玻璃景观廊桥”,所用钢化玻璃因其优良的性能广泛应用于日常生活,但由于制作玻璃时里面含有极少量硫化镍,使得钢化玻璃在极限条件下的使用受到限制.
(1)基态硫原子价层电子的轨道表达式(电子排布图)为____________,基态镍原子中核外电子占据最高能层的符号为_____________.
(2)Ni(CO)4常用于制备纯镍,溶于乙醇、CCl4、苯等有机溶剂,为___________晶体,Ni(CO)4空间构型与甲烷相同,中心原子的杂化轨道类型为___________,写出与配体互为等电子体的阴离子__________________________________________________________(任写一种).
(3)与硫同族的硒元素有两种常见的二元含氧酸,请比较它们酸性强弱 > (填化学式)______,理由是_______________________________________________________________.
(4)H2S的键角__________(填“大于”“小于””等于”)H2O的键角,请从电负性的角度说明理由___________________________________________________.
(5)NiO与NaCl的晶胞结构相似,如图所示,阴离子采取面心立方堆积,阳离子填充在位于阴离子构成的空隙中,已知Ni2+半径为69nm,O2-半径为140nm,阿伏伽德罗常数为NA,NiO晶体的密度为_________g/cm3(只列出计算式).

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于常见有机物的说法不正确的是
A. 乙醇与乙酸都可以与钠反应
B. 油脂是油和脂肪的统称,都是高级脂肪酸与甘油形成的酯
C. 1mol有机物 一定条件下能和6molNaOH反应
一定条件下能和6molNaOH反应
D. 分于式为C4H7ClO2,可与NaHCO3溶液反应产生CO2的有机物可能结构有6种
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学课题小组将二氧化硫的制备与多个性质实验进行了一体化设计,实验装置如图所示。下列说法不正确的是
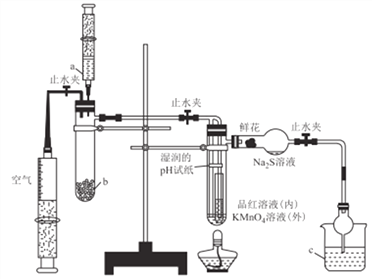
A. a、b、c中依次盛装70%硫酸.Na2SO3固体、NaOH溶液
B. 实验时,湿润的pH试纸、鲜花、品红溶液、KMnO4溶液均褪色,Na2S溶液出现淡黄色沉淀
C. 此设计可证明SO2水溶液的酸性,SO2的氧化性、还原性、漂白性
D. 点燃酒精灯加热,可证明SO2使品红溶液褪色具有可逆性,使KMnO4溶液褪色不具有可逆性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定质量的镁铜合金加入到稀硝酸中,两者恰好完全反应,假设反应过程中还原产物全是NO,向所得溶液中加入物质的量浓度为3 mol·L-1 NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加5.1 g,则下列有关叙述中正确的是( )
A. 加入合金的质量不可能为6.4 g
B. 参加反应的硝酸的物质的量为0.1 mol
C. 沉淀完全时消耗NaOH溶液的体积为150 mL
D. 溶解合金时收集到NO气体的体积在标准状况下为2.24 L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:①R—NO2![]() R—NH2;②苯环上的取代基对新导入的取代基进入苯环的位置有显著的影响。如图表示以苯为原料制备一系列有机物的转化过程:
R—NH2;②苯环上的取代基对新导入的取代基进入苯环的位置有显著的影响。如图表示以苯为原料制备一系列有机物的转化过程:
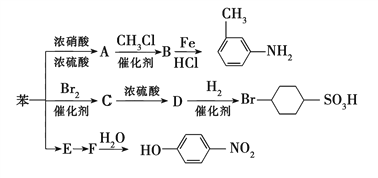
(1)A是一种密度比水___(填“大”或“小”)的无色液体,苯转化为A的化学方程式是________________________________________________。
(2)在“苯![]() C
C![]() D
D![]()
![]() ”的转化过程中,属于取代反应的是___(填序号,下同),属于加成反应的是_______。
”的转化过程中,属于取代反应的是___(填序号,下同),属于加成反应的是_______。
(3)图中“苯→E→F”的转化过程省略了反应条件,请写出E的结构简式:________。
(4)有机物B苯环上的二氯代物有___种结构;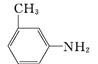 的所有原子___(填“在”或“不在”)同一平面上。
的所有原子___(填“在”或“不在”)同一平面上。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】正硼酸(H3BO3)是一种片层状结构白色晶体,有与石墨相似的层状结构,受热易分解,层内的H3BO3分子通过氢键相连(如图所示),则下列有关说法中不正确的是
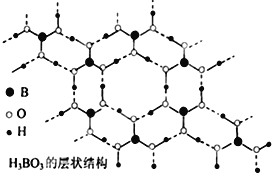
A. 正硼酸晶体属于分子晶体
B. 正硼酸分子的稳定性与氢键无关
C. 1molH3BO3晶体中含有3mol氢键
D. B原子杂化轨道的类型sp2,层间的H3BO3分子通过共价键相连
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com