
(16分)短周期元素A、B、C、D、E的原子序数依次增大,已知:
①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐;
②A的氧化物是生活中最常见液体,A、E同主族,C与B、D相邻;
③A、B、C、D四种元素组成一种离子化合物F,其组成原子数之比为5︰1︰1︰3。
请回答下列问题:
(1)C的气态氢化物的电子式为 ,A在周期表中的位置 。
(2)化合物E2D2中阴、阳离子个数比为 ,F含有的化学键类型为 。
(3)F溶液与足量EDA的稀溶液混合,其离子方程式为 。
(4)氯气与C的气态氢化物相遇有白烟及C2生成,写出其化学反应方程式 。
(5)C2A4空气燃料电池是一种环境友好的碱性燃料电池,电解质溶液是20%~30% KOH溶液。该燃料电池的负极反应式为_____ ___。
(6)用CH4可以消除汽车尾气中氮氧化物的污染。
已知:CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(l) △H=-955 kJ·mol-1
2NO2(g)=N2O4(g) △H=-56.9 kJ·mol-1
写出CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式 _________ ___
(16分)(每空2分)
(1)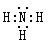 ;第一周期、第IA族
;第一周期、第IA族
(2)1:2;离子键和共价键
(3)2OH-+HCO3-+NH4+=CO32-+H2O+NH3·H2O
(4) 3Cl2+8NH3=6NH4Cl+ N2
(5) N2H4+4OH--4e-===4H2O+N2↑
(6)CH4(g)+N2O4(g) = N2(g ) +2H2O(l) + CO2(g) △H= —898.1 kJ·mol-1
) +2H2O(l) + CO2(g) △H= —898.1 kJ·mol-1
【解析】
试题分析:(1)①C的最高价氧化物对应的水化物与其气态氢化物反应可生成盐,说明C是N元素,最高价氧化物的水化物是硝酸,氢化物是氨气,氨气与硝酸反应生成硝酸铵,属于盐;②A的氧化物是生活中最常见液体,则A是H元素,其氧化物为水,A、E同主族,则E是Na元素;C与B、D相邻,则 B是C元素,D是O元素;③A、B、C、D四种元素组成一种离子化合物F,其组成原子数之比为5︰1︰1︰3,则F是NH4HCO3。C的气态氢化物是氨气,为共价化合物,所以电子式为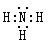 ;H元素位于元素周期表的第一周期第IA族;
;H元素位于元素周期表的第一周期第IA族;
(2)化合物Na2O2中阴离子是O22-、阳离子是Na+,所以阴、阳离子个数比为为1:2;NH4HCO3是离子化合物,含有离子键,但N与H、C与O原子之间是共价键,所以F中含有离子键和共价键;
(3)碳酸氢铵与氢氧化钠溶液反应,生成碳酸钠、一水合氨和水,离子方程式为2OH-+HCO3-+NH4+=CO32-+H2O+NH3·H2O;
(4)氯气与氨气相遇有白烟及氮气生成,白烟为氯化铵固体,则化学反应方程式为3Cl2+8NH3=6NH4Cl+ N2;
(5)N2H4的燃料电池,在碱性条件下,负极为N2H4发生氧化反应,生成氮气和水,所以电极反应式为N2H4+4OH--4e-===4H2O+N2↑;
(6)根据盖斯定律,将已知两个热化学方程式相减即可得到所求热化学方程式,则CH4催化还原N2O4(g)生成N2和H2O(l)的热化学方程式为CH4(g)+N2O4(g) = N2(g ) +2H2O(l) + CO2(g) △H= —898.1 kJ·mol-1 。
) +2H2O(l) + CO2(g) △H= —898.1 kJ·mol-1 。
考点:考查元素的推断,化合物性质的应用,电化学反应原理的应用,盖斯定律的应用


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源:2014-2015湖南省高一上学期期中考试化学试卷(解析版) 题型:选择题
下列反应中,铁元素发生氧化反应的是
A.FeS +2HCl = FeCl2 + H2S↑ B.Fe +H2SO4 = FeSO4 +H2↑
C.FeO + 2HCl =FeCl2 + H2O D.Fe2O3 +3CO = 2Fe +3CO2
查看答案和解析>>
科目:高中化学 来源:2014-2015湖南省高二上学期期中化学(文)试卷(解析版) 题型:选择题
为了使城市生活垃圾得到合理利用,必须将生活垃圾分类回收投放,其中塑料袋、废报纸、旧橡胶制品属于
A.无机物 B.有机物 C.盐类 D.非金属单质
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高二上学期第三次月考化学试卷(解析版) 题型:选择题
下列物质中互为同分异构体的是
A.O2和O3
B.
C.CH3COOH和HCOOCH3
D. 和
和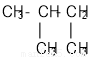
查看答案和解析>>
科目:高中化学 来源:2014-2015河北省高二上学期第三次月考化学试卷(解析版) 题型:选择题
下列有关化学用语正确的是
①乙烯的最简式C2H4
②乙醇的结构简式C2H6O
③四氯化碳的电子式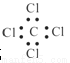
④乙炔的结构简式CHCH
⑤乙烷的结构式CH3CH3
⑥乙醛的结构简式CH3COH
A.全对 B.全错 C.③④⑤ D.③④⑥
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
下图是模拟电化学反应装置图。下列说法正确的是
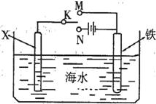
A.若X为碳棒,开关K置于N处,会加快铁的腐蚀
B.若X为锌,开关K置于N处,则X极上有黄绿色气体生成
C.若X为碳棒,开关K置于M处,则铁电极的电极反应式为: Fe-3e- =Fe3+
D.若X为锌,开关K置于M处,则总反应方程式为:2Zn+O2+2H2O=2Zn(OH)2
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省高三上学期第四次月考化学试卷(解析版) 题型:选择题
工业上生产下列物质,不涉及氧化还原反应的是
A.用铝矾土(主要成分Al2O3)生产金属铝
B.用硫铁矿(主要成分FeS2)生产硫酸
C.用海水、贝壳生产氯化镁晶体
D.用氯化钠生产烧碱
查看答案和解析>>
科目:高中化学 来源:2014-2015学年宁夏银川市高三上学期第三次月考理综试卷(解析版) 题型:实验题
(15分)熟悉和使用中学化学实验中常见仪器及用品,是化学学习的基本要求。试回答以下问题:
(1)在仪器:a.分液漏斗 b.试剂瓶 c.集气瓶 d.滴定管 e.容量瓶 f.量筒 g.托盘天平中,标有“0”刻度的是(填序号) 。
(2)蒸发皿的使用:把滤液倒入蒸发皿中,再把蒸发皿放到铁架台的铁圈上。用酒精灯加热,同时用玻璃棒不断搅拌,以防止_______________。当蒸发皿里的液体较少时,则应___________,利用余热使剩余溶剂挥发。
(3)用装置甲、乙、丙和乳胶管组成一套装置(气密性已检查),可用于制取并收集NH3或HCl气体。可供选择的液体试剂有:浓硫酸、浓盐酸、浓氨水,丙中试剂为紫色石蕊溶液。请回答下列问题:
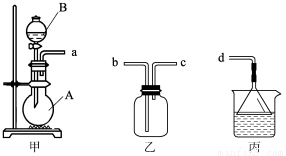
① 若制取某气体的过程中,丙中的石蕊溶液变红,且烧瓶中的试剂A与分液漏斗中的试剂B均为无色液体,则试剂A为 ,制取该气体利用了B的性质有 、 。通过丙中紫色石蕊溶液变红或变蓝,说明乙中气体已集满。若石蕊溶液变蓝,则烧瓶甲中应加入的固体试剂A为 ;
② 若在乙中收集氨气,气体流经装置的顺序是:a→ → →d(填接口代号)。
(4)下图中的装置D是实验室制备CO2的简易装置图,用该装置制备CO2可起到随时使反应发生,也可以随时使反应停止的效果。下图中的装置A、B、C也可起到相同效果的有 (填写编号)。
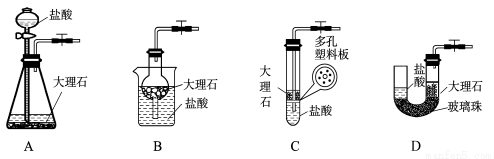
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省德阳市高三一诊考试化学试卷(解析版) 题型:选择题
已知甲、乙、丙三种物质均含有同一种中学常见元素X,其转化关系如下:
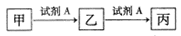
下列说法不正确的是
A.若乙为NaHCO3,则丙一定是CO2
B.若A为氯水,X为金属元素,则甲与丙反应可生成乙
C.若A为NaOH溶液,X为短周期的金属元素,则乙一定为白色沉淀
D.若甲为单质硫,则丙溶于水形成的浓溶液能与碳反应可生成乙
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com