
分析 铜与一定浓度的硝酸和硫酸的混合酸反应,生产的盐只有硫酸铜,同时生成的两种气体由两种元素组成,气体的相对分子质量都小于50,应为二氧化氮和一氧化氮,分别设出二氧化氮、一氧化氮的物质的量,根据原子守恒、电子守恒列式计算出二氧化氮、NO的物质的量;根据电子守恒可计算出参与反应的Cu的物质的量,可得硫酸铜的物质的量.
解答 解:铜与一定浓度的硝酸和硫酸的混合酸反应,生产的盐只有硫酸铜,同时生成的两种气体由两种元素组成,气体的相对分子质量都小于50,应为二氧化氮和一氧化氮,
1.5 mol氧气参与反应转移电子的物质的量为5.5mol×4=6mol,生成的最高价含氧酸盐为NaNO3,
假设二氧化氮的物质的量为x mol,NO的物质的量为y mol,则:
$\left\{\begin{array}{l}{x+y=1.5×2.4}\\{x+3y=6}\end{array}\right.$
解得:x=2.4,y=1.2,
根据电子守恒,参与反应的Cu的物质的量为:n(Cu)=$\frac{6mol}{2}$=3mol,则生成硫酸铜的物质的量为3mol,
故答案为:NO 1.2mol,NO2 2.4mol;3mol.
点评 本题考查混合物有关计算,注意掌握守恒思想在化学计算中的应用,试题培养了学生的分析能力及化学计算能力.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
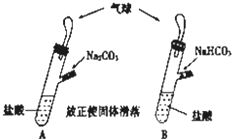 有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2CO3和0.84gNaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )
有A、B两个完全相同的装置,某学生分别在它们的侧管中装入1.06g Na2CO3和0.84gNaHCO3,A、B中分别有10mL相同浓度的盐酸,将两个侧管中的物质同时倒入各自的试管中,下列叙述正确的是( )| A. | A装置的气球膨胀速度比B快 | |
| B. | 若最终两气球体积相同,则盐酸的浓度一定大于或等于2 mol/L | |
| C. | 若最终两气球体积不同,则盐酸的浓度一定小于或等于1 mol/L | |
| D. | 最终两试管中Na+、Cl-的物质的量一定相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 石灰乳与Na2CO3溶液混合:Ca2++CO32-→CaCO3↓ | |
| B. | 酸性条件下KIO3溶液与KI溶液发生反应生成I2:IO3-+5I-+3H2O→3I2+6OH- | |
| C. | 向100mL0.1mol/L 的溴化亚铁溶液中通入0.05mol的氯气:2Fe2++4Br-+3Cl2→2 Fe3++2Br2+6Cl- | |
| D. | AgNO3溶液中加入过量的氨水:Ag++NH3•H2O→AgOH↓?+NH4+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 铅蓄电池的A极为阴极 | |
| B. | 电解的过程中有H+从右池移动到左池 | |
| C. | 该电解池的阴极反应为:2NO3-+6H2O+12e-=N2↑+12OH- | |
| D. | 若电解过程中转移1moL电子,则交换膜两侧电解液的质量变化差为7.2g |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Mg和Zn | B. | Zn和Fe、C | C. | Cu和Fe | D. | Zn和Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com