
下列叙述正确的是
A.Na在足量O2中燃烧,消耗lmol O2时转移的电子数是4×6.02×1023
B.盐酸和醋酸的混合溶液pH=1,该溶液中c(H+) = 0.1 mol/L
C.1 L 0.1 mol/L NH4Cl溶液中的N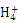 数是0.1×6.02×1023
数是0.1×6.02×1023
D.标准状况下2.24 L Cl2中含有0.2 mol 共价键
科目:高中化学 来源:2014-2015学年湖南省怀化市高三学业水平模拟考试化学试卷(解析版) 题型:选择题
下列反应,属于加成反应的是
A.CH4+Cl2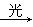 CH3Cl+HCl
CH3Cl+HCl
B.C6H6+Br2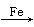 C6H5Br+HBr
C6H5Br+HBr
C.CH2==CH2+Br2―→CH2Br—CH2Br
D.CH3COOH+CH3CH2OH 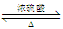 CH3COOCH2CH3+H2O
CH3COOCH2CH3+H2O
查看答案和解析>>
科目:高中化学 来源:2014-2015学年广东省揭阳市高三毕业班二模考试理综化学试卷(解析版) 题型:选择题
下列陈述I、II正确并且有因果关系的是
选项 | 陈述I | 陈述II |
A | H2O2、SO2都能使酸性高锰酸钾溶液褪色 | 前者表现出还原性后者表现出漂白性 |
B | 纯银器表面在空气中渐渐变暗 | 发生化学腐蚀 |
C | SiO2能与氢氟酸及碱反应 | SiO2是两性氧化物 |
D | BaSO4饱和溶液中加入饱和Na2CO3溶液有白色沉淀 | 说明Ksp(BaSO4)大于Ksp(BaCO3) |
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市高三4月模拟考理综化学试卷(解析版) 题型:推断题
【化学—选修5有机化学基础】石油化工的重要原料CxHy可以合成很多有机化合物,以下是CxHy合成物质E和J的流程图:
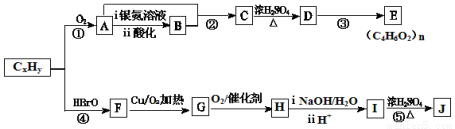
已知:Ⅰ.下列反应中R、R′代表烃基
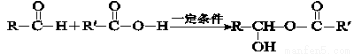
Ⅱ.J的分子式为C4H4O4 ,是一种环状化合物。
(1)在CxHy的同系物中,所有碳原子一定共平面且碳原子数最多的分子的名称是____。
(2)H的分子式是 。
(3)下列说法正确的是 。
a.CxHy和苯都能使溴水褪色,原理相同
b.反应②和反应④的反应类型均为加成反应
c.C能与Na、NaOH、NaHCO3反应
d.E是一种水溶性很好的高分子化合物
e.J在酸性或碱性环境中均能水解
(4)K是J的同分异构体,且1 mol K与足量的NaHCO3溶液反应可放出2mol CO2气体,请写出两种符合条件K的结构简式____。
(5)写出反应⑤的化学方程式______________。
(6)D有多种同分异构体,与D具有相同官能团的还有种(含顺反异构体),其中核磁共振氢谱有3组吸收峰,且能发生银镜反应的结构简式是__________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市高三4月模拟考理综化学试卷(解析版) 题型:选择题
某小组为研究电化学原理,设计甲、乙、丙三种装置(C1、C2、C3均为石墨)。下列叙述正确的是

A.甲、丙中是化学能转变为电能,乙中是电能转变为化学能
B.C1、C2分别是阳极、阴极,锌片、铁片上都发生氧化反应
C.C1上和C3上放出的气体相同,铜片上和铁片上放出的气体也相同
D.甲中溶液的pH逐渐升高,丙中溶液的pH逐渐降低
查看答案和解析>>
科目:高中化学 来源:2014-2015学年四川省成都市第三次诊断化学试卷(解析版) 题型:选择题
工业上用DME法以H2和CO为原料生产甲醚(CH3 OCH3)。其原理是在同一容器中发生如下两个连续反应:
①2H2(g) +CO(g) CH3OH(g)
CH3OH(g)
②2CH3OH(g) CH3OCH3(g)+H2O(g)
CH3OCH3(g)+H2O(g)
当达到平衡时实验数据如表,下列分析正确的是
温度(℃) 平衡态 | 260 | 270 | 280 | 290 | 300 | 310 | 320 |
CO转化率(%) | 92 | 87 | 82 | 80 | 72 | 65 | 62 |
CH3OCH3产率(%) | 33 | 45 | 77 | 79 | 62 | 58 | 52 |
A.反应①、②均为吸热反应
B.290℃时反应②平衡常数值达到最大
C.平衡时,反应①与②中CH3OH的消耗速率一定相等
D.增大压强能增大CH3OCH3产率
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期第一次月考理综化学试卷(解析版) 题型:简答题
(16分) 化学反应原理在科研和生产中有广泛应用。
(1)利用“化学蒸气转移法”提纯金属钨的反应原理为W(s)+I2(g) WI2(g)。该反应在石英真空管中进行,如下图所示:
WI2(g)。该反应在石英真空管中进行,如下图所示:
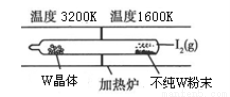
①该反应的平衡常数表达式K=_______,若K=1/2,向某恒容密闭容器中加入1mol I2(g)和足量W(s),反应达到平衡时I2(g)的转化率为__________。
②该反应的△H____0(填“>”或“<”),上述反应体系中可循环使用的物质____。
③能够说明上述反应已经达到平衡状态的有_________(填序号)。
a.I2与WI2的浓度相等
b.W的质量不再变化
c.容器内混合气体的密度保持不变
d.单位时间内,金属钨消耗的物质的量与碘化钨生成的物质的量相等
(2)利用“隔膜电解法”处理高浓度乙醛废水的工艺具有流程简单、能耗较低等优点,其原理是使乙醛分别在阴、阳极发生反应生成乙醇和乙酸,总反应式为2CH3CHO+H2O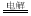 CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
CH3CH2OH+CH3COOH,实验室中,以一定浓度的乙醛和Na2SO4溶液为电解质溶液,模拟乙醛废水的处理过程,其装置如图所示。
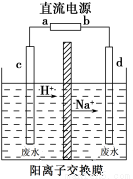
①若以甲烷碱性燃料电池为直流电源,则燃料电池中b极应通入__________(填化学式)。
②电解池阳极区的电极反应式为_________________。
③在实际工艺处理中,阴极区乙醛的去除率可达60%。若在两极区分别注入1 m3乙醛含量为3000 mg·L-1的废水,可得到乙醇________kg(计算结果保留小数点后一位)。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年重庆市高三下学期二模考试理综化学试卷(解析版) 题型:选择题
某种药物合成中间体的结构简式为: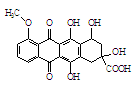 ,有关该物质的说法不正确的是
,有关该物质的说法不正确的是
A.属于芳香族化合物
B.能发生消去反应和酯化反应
C.能分别与金属Na、NaHCO3溶液反应
D.1 mol该有机物与足量NaOH溶液反应,消耗5 mol NaOH
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省枣庄市高三4月模拟考试化学试卷(解析版) 题型:实验题
(14分)亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及砂糖、油脂的漂白与杀菌。以下是过氧化氢法生产亚氯酸钠的工艺流程图:

已知:①NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO23H2O。
②纯ClO2易分解爆炸,一般用稀有气体或空气稀释到10%以下安全。
③160 g/L NaOH溶液是指160 gNaOH固体溶于水所得溶液的体积为1L。
(1)160 g/L NaOH溶液的物质的量浓度为 。
(2)发生器中鼓入空气的作用可能是 (选填序号)。
a.将SO2氧化成SO3,增强酸性;
b.稀释ClO2以防止爆炸;
c.将NaClO3氧化成ClO2
(3)吸收塔内的反应的化学方程式为 。
吸收塔的温度不能超过20℃,其目的是 。
(4)在碱性溶液中NaClO2比较稳定,所以吸收塔中应维持NaOH稍过量,判断NaOH是否过量的简单实验方法是 。
(5)吸收塔中为防止NaClO2被还原成NaCl,所用还原剂的还原性应适中。除H2O2外,还可以选择的还原剂是 (选填序号)。
a.Na2O2 b.Na2S c.FeCl2
(6)从滤液中得到NaClO23H2O粗晶体的实验操作依次是 (选填序号)。
a.蒸馏
b.蒸发
c.灼烧
d.过滤
e.冷却结晶
要得到更纯的NaClO23H2O晶体必须进行的操作是 (填操作名称)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com