
| A. | 向豆浆中加入硫酸钙做豆腐 | |
| B. | 将植物油倒入水中用力搅拌形成油水混合物 | |
| C. | 利用丁达尔效应可以区别溶液与胶体 | |
| D. | 观看电影时,从放映机到银幕有明显的光路 |
科目:高中化学 来源: 题型:选择题
| A. | 钠在氯气中燃烧 | B. | 二氧化碳通入澄清的石灰水中 | ||
| C. | 氯化钠溶液中滴加硝酸银溶液 | D. | 锌粒放入稀硫酸中 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 弱酸性溶液中:Na+、NH4+、NO3-、Cl- | |
| B. | 无色溶液中:Fe3+、NH4+、Cl-、HS- | |
| C. | 水电离出的C(H+)=1×10-13mol•L-1的溶液中:Ca2+、HCO3-、I-、NO3- | |
| D. | 漂白粉的水溶液中:Fe2+、SO42-、Mg2+、Na+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 在化学反应中,化学能只可以转化为热能 | |
| B. | 化学键的断裂和形成是化学反应中能量变化的主要原因 | |
| C. | 已知2H2(g)+O2(g)=2H2O(l)△H<0,当反应达平衡后升高温度,反应逆向移动,逆反应速率增大,正反应速率减小 | |
| D. | 合成氨反应N2+3H2?2NH3,当N2、H2、NH3浓度相等时该反应达到了最大限度 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Cu(OH)2+HC1; Cu(OH)2+CH3COOH | B. | NaHCO3+H2SO4;Na2CO3+HCl | ||
| C. | NaHS04+NaOH; H2SO4+NaOH | D. | BaCl2与 Na2SO4;Ba(OH)2 与 CuSO4 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ/mol | B. | 2H2(g)+O2(g)=2H2O(l)△H=-483.6kJ/mol | ||
| C. | 2H2(g)+O2(g)=2H2O(g)△H=-241.8kJ/mol | D. | 2H2(g)+O2(g)=2H2O(l)△H=-241.8kJ/mol |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
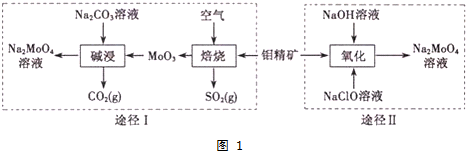
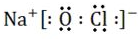
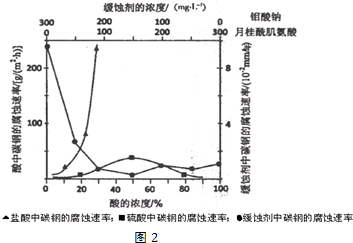
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com