
| Fe(OH)2 | Fe(OH)3 | Cr(OH)3 | Ni(OH)2 | |
| Ksp | 8.0×10-16 | 4.0×10-38 | 6.0×10-31 | 6.5×10-18 |
| 完全沉淀pH | ≥9.6 | ≥3.2 | ≥5.6 | ≥8.4 |
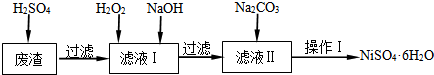
分析 废渣(除含镍外,还含有Cu、Fe、Cr等杂质),在硫酸溶解过滤后除去不溶于硫酸的铜,所以滤液含有二价铁离子、三价铁离子、三价铬离子杂质,加H2O2是将二价铁氧化成三价铁,再通过调节PH值5.6~8.4使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅱ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4.
(1)能提高废渣浸出率从反应效率考虑分析;
(2)根据H2O2强氧化性及其除杂离子的原理分析;
(3)经过加入H2O2、NaOH后可除去Cu、Zn、Fe、Cr等杂质,滤液中含有可溶性硫酸盐;
(4)检验废液中是否还含有Ni2+离子;
(5)得到NiCO3沉淀之后应,应先过滤、洗涤,然后与硫酸反应生成NiSO4.
解答 解:废渣(除含镍外,还含有Cu、Fe、Cr等杂质),在硫酸溶解过滤后除去不溶于硫酸的铜,所以滤液含有二价铁离子、三价铁离子、三价铬离子杂质,加H2O2是将二价铁氧化成三价铁,再通过调节PH值5.6~8.4使三价铁和三价铬都以氢氧化物的沉淀而除去,滤液Ⅱ含有可溶性硫酸盐,为Na2SO4、NiSO4,再加碳酸钠沉淀二价镍,过滤、洗涤,然后与硫酸反应生成NiSO4.
(1)能提高废渣浸出率即提高反应速率,所以AC都可以提高反应速率,而B增大压强对反应没影响,故选:AC;
(2)因为废渣(除含镍外,还含有Cu、Fe、Cr等杂质),加快氧化的速率,同时防止H2O2的分解;在硫酸溶解过滤后含有二价铁离子、三价铁离子、三价铬离子杂质,所以加H2O2是将二价铁氧化成三价铁,再通过调节PH值5.6~8.4使三价铁和三价铬都以氢氧化物的沉淀而除去,故答案为:2Fe2++H2O2+2H+=2Fe3++2H2O;加快氧化的速率,同时防止H2O2的分解;[5.6,8.4);Fe3+、Cr3+;
(3)经过加入H2O2、NaOH后可除去Fe、Cr等杂质,滤液中含有可溶性硫酸盐,为Na2SO4、NiSO4,故答案为:Na2SO4、NiSO4;
(4)检验Ni2+已完全沉淀的实验方法是静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成,故答案为:静置后向上层清液中再加入Na2CO3溶液后没有沉淀生成;
(5)得到NiCO3沉淀之后应,应先过滤、洗涤,然后与硫酸反应生成NiSO4,所以操作步骤为:①过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性;
故答案为:过滤,并用蒸馏水洗涤沉淀2~3次直至流出液用pH试纸检验呈中性.
点评 本题考查物质的分离提纯的实验方案的设计,题目难度较大,明确实验的目的和原理是解答该题的关键,注意把握基本实验操作.


科目:高中化学 来源: 题型:选择题
| A. | 1:2 | B. | 2:1 | C. | 1:1 | D. | 3:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质 | 乙醛 | 乙酸 | 甘油 | 乙二醇 | 水 |
| 沸点 | 20.8℃ | 117.9℃ | 290℃ | 197.2℃ | 100℃ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 物质类别 | 具体物质 | 物质类别 | 具体物质 |
| 压缩气体和液化气体 | 氩气、压缩天然气易燃固体、自然物品和遇湿易燃物品 | 硫磺、硝化纤维素、电石、硅钙合金、钠、钾 | |
| 氧化剂和有机过氧化物 | 硝酸钾、硝酸钠、过氧乙酸 | 易燃液体 | 甲乙酮、乙酸乙酯 |
| 腐蚀品、杂类 | 甲酸、磷酸、甲基磺酸、烧碱、硫化碱 | 毒害品 | 氰化钠、甲苯二异氰酸酯 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 实验室中取用少量钠需要用到的实验用品有镊子、滤纸、玻璃片和小刀 | |
| B. | 操作②、操作③分别是过滤与蒸发结晶 | |
| C. | 反应①加料之前需将反应器加热至100℃以上并通入氩气 | |
| D. | 反应①中氧化剂与还原剂的物质的量之比为1:2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 5:3:2 | B. | 3:2:2 | C. | 5:4:1 | D. | 3:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.
为处理氯甲烷生产企业的副产物CCl4,以减少其对臭氧层的破坏.化学家研究在催化条件下,通过反应CCl4+H2?CHCl3+HCl△H<O,使CCl4转化为重要的化工原料氯仿(CHCl3).已知CCl4的沸点为77℃,CHCl3的沸点为61.2℃.在密闭容器中,该反应达到平衡后,测得如下数据.| 实验序号 | 温度℃ | 初始CCl4浓度(mol•L-1) | 初始H2浓度(mol•L-1) | CCl4的转化率 |
| 1 | 110 | 1 | 1 | 50% |
| 2 | 100 | 1 | 1 | x |
| 3 | 110 | 0.8 | y | 60% |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com