
| A. | 石墨 | B. | 铂丝 | C. | 碳钢网 | D. | 铅 |
分析 离子交换膜电解槽主要由阳极、阴极、离子交换膜、电解槽框和导电铜棒等组成,每台电解槽由若干个单元槽串联或并联组成,电解槽的阳极用金属钛网制成,为了延长电极使用寿命和提高电解效率,钛阳极网上涂有钛、钌等氧化物涂层;阴极由碳钢网制成,上面涂有镍涂层;阳离子交换膜把电解槽隔成阴极室和阳极室,阳离子交换膜有一种特殊的性质,即它只允许阳离子通过,而阻止阴离子和气体通过,也就是说只允许Na+通过,而Cl-、OH-和气体则不能通过,这样既能防止阴极产生的H2和阳极产生的Cl2相混合而引起爆炸,又能避免Cl2和NaOH溶液作用生成NaClO而影响烧碱的质量.
解答 解:电解槽的阳极用金属钛网制成,为了延长电极使用寿命和提高电解效率,钛阳极网上涂有钛、钌等氧化物涂层;阴极由碳钢网制成,上面涂有镍涂层,故选C.
点评 本题考查了离子交换膜电解槽结构、原理和电极材料、电极反应等知识,掌握基础注意知识积累,掌握基础是解题关键,题目难度不大.


科目:高中化学 来源: 题型:选择题
| A. | HNO3 KOH Na2CO3 O2 | B. | NaHCO3Ba(OH)2 NaCl Zn | ||
| C. | H2SO4 Na2O MgCl2 C | D. | HCl KOH Na2CO3 SiO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ③④ | B. | ①③⑤ | C. | 仅有⑤ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
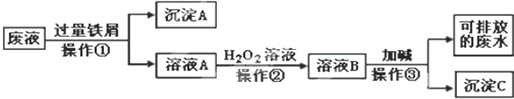
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 112号元素是金属元素 | |
| B. | 112号元素位于第七周期,是主族元素 | |
| C. | ${\;}_{112}^{277}$R原子中子数为165 | |
| D. | 112号元素为放射性元素 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
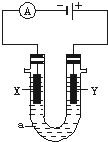 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 乙烯的结构简式CH2CH2 | B. | 乙醇的分子式C2H6O | ||
| C. | 乙酸乙脂的结构简式是CH3COOC2H5 | D. | 四氯化碳的电子式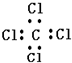 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com