
【题目】化学是一门以实验为基础的学科,试回答以下问题:
I用质量分数为36.5%的浓盐酸(密度为1.16 g·cm-3)配制成1 mol·L-1的稀盐酸。现实验室仅需要这种盐酸220 mL,试回答下列问题:
(1)配制稀盐酸时,应选用容量为________mL的容量瓶。
(2)经计算需要________mL浓盐酸,在量取时宜选用下列量筒中的________。
A.5 mL B.10 mL C.25 mL D.50 mL
(3)在量取浓盐酸后,进行了下列操作:
①等稀释的盐酸的温度与室温一致后,沿玻璃棒注入250 mL容量瓶中。
②往容量瓶中小心加蒸馏水至液面离容量瓶刻度线1~2 cm时,改用胶头滴管加蒸馏水,使溶液的液面与瓶颈的刻度标线相切。
③在盛盐酸的烧杯中注入蒸馏水,并用玻璃棒搅动,使其混合均匀。
④用蒸馏水洗涤烧杯和玻璃棒2至3次,并将洗涤液全部注入容量瓶。
上述操作中,正确的顺序是(填序号)____________。
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,其配制的稀盐酸浓度________(填“偏高”、“偏低”或“无影响”)。若未用蒸馏水洗涤烧杯内壁或未将洗涤液注入容量瓶,则配制的稀盐酸浓度是________(填“偏高”、“偏低”或“无影响”)。
II实验室用以下装置进行实验

(5)装置甲和戊用于制取并收集少量氨气,甲中发生反应的化学方程式为: ______________________。 戊装置收集氨气应从收集装置的_____(填字母序号)导管进气。
(6)选用装置乙、丙、戊制备、收集一氧化氮气体,乙中塑料板上若放置石灰石,戊中 盛满稀NaOH溶液,仪器正确的连接顺序为________________________ (用接口字母表示)。
【答案】250 21.6 C ③①④② 偏低 偏低 2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O e abcd(e)
CaCl2+2NH3↑+2H2O e abcd(e)
【解析】
I.(1)容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,据此选择;(2)先计算出浓盐酸的物质的量浓度为c=![]() ,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;根据“大而近”的原则,根据需要量取的浓盐酸的体积来选择合适的量筒;(3)根据配制步骤即:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;(4)根据c=
,然后根据溶液稀释定律C浓V浓=C稀V稀来计算;根据“大而近”的原则,根据需要量取的浓盐酸的体积来选择合适的量筒;(3)根据配制步骤即:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶来对操作顺序进行排序;(4)根据c=![]() 并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
并结合溶质的物质的量n和溶液的体积V的变化来进行误差分析;
II. (5)图1中在加热条件下,氯化铵与氢氧化钙反应生成氨气;氨气的密度比空气的小,用向下排空气法收集;(6)NO易与空气中的氧气反应,用CO2排尽装置中的空气,则乙中制备二氧化碳,丙制备NO,戊收集NO。
I.(1)容量瓶只有一条刻度线,故只能配制和其规格相对应的体积的溶液,常用的规格有100mL、250mL、500mL、1000mL,现在需要这种盐酸220mL,故应选用250mL容量瓶;
(2)浓盐酸的物质的量浓度为c=![]() =
=![]() mol/L =11.6mol/L,设需要浓盐酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:11.6mol/L×VmL=1mol/L×250mL,解得V=21.6mL.根据“大而近”的原则,需要量取浓盐酸的体积为21.6mL时应选择25mL量筒,故答案为C;
mol/L =11.6mol/L,设需要浓盐酸的体积为VmL,根据溶液稀释定律C浓V浓=C稀V稀可知:11.6mol/L×VmL=1mol/L×250mL,解得V=21.6mL.根据“大而近”的原则,需要量取浓盐酸的体积为21.6mL时应选择25mL量筒,故答案为C;
(3)配制一定物质的量浓度的溶液的步骤是:计算、量取、稀释、冷却、移液、洗涤、定容、摇匀、装瓶,则操作顺序进行排序为:③①④②;
(4)在上述配制过程中,用刚刚洗涤洁净的量筒来量取浓盐酸,会对浓盐酸造成稀释,导致所取的盐酸的物质的量偏小,则其配制的稀盐酸浓度偏低;若未用蒸馏水洗涤烧杯内壁和玻璃棒或未将洗涤液注入容量瓶,会造成溶质的损失,则配制的稀盐酸浓度偏低;
II.(5)在加热条件下,氯化铵与氢氧化钙反应生成氨气,其反应的化学方程式为:2NH4Cl+Ca(OH)2![]() CaCl2+2NH3↑+2H2O;氨气的密度比空气的小,用向下排空气法收集,所以氨气应从收集装置的e导气管进入;
CaCl2+2NH3↑+2H2O;氨气的密度比空气的小,用向下排空气法收集,所以氨气应从收集装置的e导气管进入;
(6)NO易与空气中的氧气反应,用CO2排尽装置中的空气,则乙中塑料板上放置大理石与硝酸反应生成CO2,丙制备NO,戊收集NO,仪器正确的连接顺序为abcd。


 全优冲刺100分系列答案
全优冲刺100分系列答案 英才点津系列答案
英才点津系列答案科目:高中化学 来源: 题型:
【题目】(1)有一真空瓶质量为m1,该瓶充入空气后质量为m2。在相同状况下,若改为充入某气体A时,总质量为m3。已知空气相对分子质量为29,则A的相对分子质量是_______________
(2)把一定量铁粉放入氯化铁溶液中,完全反应后,得到溶液中Fe2+和Fe3+的浓度恰好相等。则已反应的Fe3+和未反应的Fe3+的物质的量之比为___________
(3)已知铜和稀硝酸反应方程式为3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O,则被氧化的物质与被还原的物质质量比为___________
(4)A、B两个烧瓶中分别装80mL 3.0 mol/L的盐酸和NaOH溶液,再分别加等质量的铝粉,在相同状况下产生的气体的体积比为A:B=2:5,则加入铝粉的质量为___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H2O2分解速率受多种因素影响。实验测得70℃时不同条件下H2O2浓度随时间的变化如下图所示。下列说法正确的是
A.  图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
图甲表明,其他条件相同时,H2O2浓度越小,其分解速率越快
B.  图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
图乙表明,其他条件相同时,溶液pH越小,H2O2分解速率越快
C.  图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
图丙表明,少量Mn2+存在时,溶液碱性越强,H2O2分解速率越快
D. 
 图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
图丙和图丁表明,碱性溶液中,Mn2+对H2O2分解速率的影响大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列实验操作和现象所得出的结论正确的是
选项 | 实验操作和现象 | 结论 |
A | 向苯酚浊液中滴加Na2CO3溶液,浊液变清 | 苯酚的酸性强于H2CO3的酸性 |
B | 向碘水中加入等体积CCl4,振荡后静置,上层接近无色,下层显紫红色 | I2在CCl4中的溶解度大于在水中的溶解度 |
C | 向CuSO4溶液中加入铁粉,有红色固体析出 | Fe2+的氧化性强于Cu2+的氧化性 |
D | 向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成 | Ksp(AgCl) >Ksp(AgI) |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质分类的正确组合是( )
碱 | 酸 | 盐 | 碱性氧化物 | 酸性氧化物 | |
A | Cu2(OH)2CO3 | H2SO4 | NaHCO3 | SiO2 | CO2 |
B | NaOH | HCl | NaCl | Na2O | CO |
C | NaOH | NH3 | CaCl2 | MgO | SO2 |
D | KOH | HNO3 | CaCO3 | CaO | SO2 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.现有五种溶液,分别含下列离子:①Ag+,②Mg2+,③Fe2+,④Al3+,⑤Fe3+。
(1)写出符合下列条件的离子符号:既能被氧化又能被还原的离子是______,加铁粉后溶液增重的是____;
(2)向Fe2+的溶液中滴加NaOH溶液,现象是__________________。
(3)除去FeCl2中FeCl3中所涉及的离子方程式:________________。
II.(1)如图所示,将氯气依次通过盛有干燥有色布条的广口瓶和盛有湿润有色布条的广口瓶,可观察到的现象是:____________,该实验证明起漂白作用的是______。(填化学式)
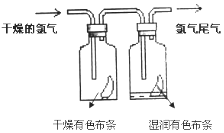
(2)①氯气有毒,实验室吸收多余的氯气的原理是(用离子方程式表示)__________________;
②根据这一原理,工业上常用廉价的石灰乳吸收工业氯气尾气制得漂白粉,漂白粉的有效成分是_________(填化学式)。
③长期露置于空气中的漂白粉会失效,失效的原因是(用化学方程式表示)___________________________,________________________。
④漂白粉是否完全失效可用稀盐酸检验,加稀盐酸后产生的气体是______(填字母代号)。
A.O2 B.Cl2 C.CO2 D.HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 淀粉和纤维素在酸催化下完全水解后的产物都是葡萄糖
B. 乙醛和丙烯醛(![]() )不是同系物,它们与氢气充分反应后的产物也不是同系物
)不是同系物,它们与氢气充分反应后的产物也不是同系物
C. 乳酸薄荷醇酯(![]() )仅能发生水解、氧化、消去反应
)仅能发生水解、氧化、消去反应
D. 现代化学分析中,可采用质谱法来确定有机物分子中的官能团
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com