
右图曲线a和b是盐酸与氢氧化钠的相互滴定的滴定曲线,下列叙述正确的是( )
A.盐酸的物质的量浓度为1 mol/L
B.P点时反应恰好完全,溶液呈中性
C.曲线a是盐酸滴定氢氧化钠的滴定曲线
D.酚酞不能用作本实验的指示剂
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
某研究性学习小组为了探究醋酸的电离情况,进行了如下实验.
[实验一] 配制并标定醋酸溶液的浓度
取冰醋酸配制250 mL 0.2 mol/L的醋酸溶液,用0.2 mol/L的醋酸溶液稀释成所需浓度的溶液,再用NaOH标准溶液对所配醋酸溶液的浓度进行标定。回答下列问题。
(1)配制250 mL 0.2 mol/L醋酸溶液时需要用到的玻璃仪器有量筒、烧杯、玻璃棒、________和________。
(2)为标定某醋酸溶液的准确浓度,用0.200 0 mol/L的NaOH溶液对20.00 mL醋酸溶液进行滴定,几次滴定消耗NaOH溶液的体积如下:
| 实验序号 | 1 | 2 | 3 | 4 |
| 消耗NaOH溶液的体积(mL) | 20.05 | 20.00 | 18.80 | 19.95 |
则该醋酸溶液的准确浓度为________(保留小数点后四位)。
[实验二] 探究浓度对醋酸电离程度的影响
用pH计测定25℃时不同浓度的醋 酸的pH,结果如下:
酸的pH,结果如下:
| 醋酸浓度(mol/L) | 0.001 0 | 0.010 0 | 0.020 0 | 0.100 0 | 0.200 0 |
| pH | 3.88 | 3.38 | 3.23 | 2.88 | 2.73 |
回答下列问题:
(1)根据表中数据,可以得出醋酸是弱电解质的结论,你认为得出此结论的依据是:________________________________________________________________________
________________________________________________________________________。
(2)从表中的数据,还可以得出另一结论:随着醋酸浓度的减小,醋酸的电离程度将________(填“增大”、“减小”或“不变”)。
[实验三] 探究温度对醋酸电离程度的影响
请你设计一个实验完成该探究,请简述你的实验方案:
________________________________________________________________________
________________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
用高铁酸钠(Na2FeO4)对河水进行消毒是城市饮水处理的新技术。已知反应Fe2O3+3Na2O2===2Na2FeO4+Na2O,下列说法正确的是
A.Na2O2既是氧化剂又是还原剂
B.Fe2O3在反应中得到电子
C.3 mol Na2O2发生反应,有12 mol e-转移
D.Na2FeO4能杀菌消毒是因为其具有强氧化性
查看答案和解析>>
科目:高中化学 来源: 题型:
下图是验证氯酸钾和浓盐酸反应的装置,乙、丙是师生对实验改进后的装置[已知:KClO3+6HCl(浓)  KCl+3Cl2↑+3H2O]:
KCl+3Cl2↑+3H2O]:

(1)和装置甲相比,装置乙的优点是__________________________________________。
(2)和装置B相比,装置D制备氯气的优点是_____________________________________________。
(3)为了进一步验证氯气和水的反应,某学生设计了装置丙。如何控制弹簧夹才能使氯气充满集气瓶F?
__________________________________________。
(4)当气体充满集气瓶F后,欲使装置E中的水进入集气瓶F应如何操作?
____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
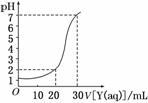 如图为对10 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像,依据图像推出X和Y的物质的量浓度是下表内各组中的( )
如图为对10 mL一定物质的量浓度的盐酸X用一定物质的量浓度的NaOH溶液Y滴定的图像,依据图像推出X和Y的物质的量浓度是下表内各组中的( )
| A | B | C | D | |
| X/mol/L | 0.12 | 0.04 | 0.03 | 0.09 |
| Y/mol/L | 0.04 | 0.12 | 0.09 | 0.03 |
查看答案和解析>>
科目:高中化学 来源: 题型:
常温下,下列叙述不正确的是( )
A.c(H+)>1×10-7 mol·L-1的溶液一定显酸性
B.pH=3的弱酸溶液与pH=11的强碱溶液等体积混合后溶液呈酸性
C.pH=5的硫酸溶液稀释到原来的500倍,稀释后c(SO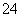 )与c(H+)之比约为1∶10
)与c(H+)之比约为1∶10
D.中和10 mL 0.1 mol/L醋酸与100 mL 0.01 mol/L醋酸所需NaOH的物质的量不同
查看答案和解析>>
科目:高中化学 来源: 题型:
在一定温度下,可逆反应N2(g)+3H2(g) 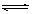 2NH3(g)达到平衡的标志是 ( )
2NH3(g)达到平衡的标志是 ( )
A.N2 H2 NH3 的浓度相等
B.1个N≡N键断裂的同时,有6个N-H键形成
C.N2 H2 NH3的分子数比为1:3:2
D.单位时间消耗n mol N2 ,同时生成3n mol H2
查看答案和解析>>
科目:高中化学 来源: 题型:
在密闭容中发生下列反应aA(g)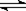 cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,下列叙述正确的是 ( )
cC(g)+dD(g),反应达到平衡后,将气体体积压缩到原来的一半,当再次达到平衡时,D的浓度为原平衡的1.6倍,下列叙述正确的是 ( )
A.A的转化率变大 B.平衡向正反应方向移动
C.D的体积分数变大 D.a < c+d
查看答案和解析>>
科目:高中化学 来源: 题型:
下列用品的有效成分及用途对应错误的是
| A | B | C | D | |
| 用品 |
|
|
|
|
| 有效成分 | NaCl | Na2CO3 | Al(OH)3 | Ca(ClO)2 |
| 用途 | 做调味品 | 做发酵粉 | 做抗酸药 | 做消毒剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com