
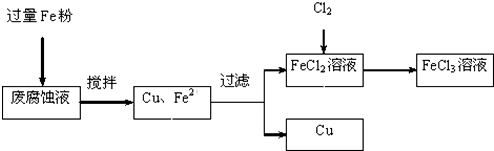
分析 测得某废腐蚀液中含CuCl2 1.5mol/L、FeCl2 3.0mol/L、FeCl3 1.0mol/L、HCl 3.0mol/L,取废腐蚀液200mL,向废腐蚀液中加入过量Fe粉,发生的反应有CuCl2+Fe=Cu+FeCl2、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑,然后过滤得到Cu、Fe和FeCl2溶液,向滤液中通入氯气发生反应2FeCl2+Cl2=2FeCl3,从而得到氯化铁溶液;
(1)Cu粉中含有Fe,用稀盐酸除去Cu中Fe;
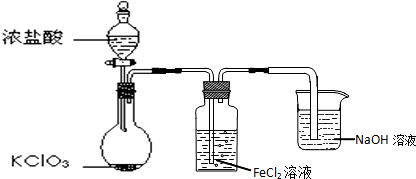
(2)实验室可用固体KClO3与浓HCl反应制备Cl2,此反应中Cl2既是氧化产物,又是还原产物,根据元素守恒知,还生成氯化钾和水;
(3)缓慢旋动分液漏斗的活塞,调节液体滴下的速度,从而控制生成氯气速率;
(4)根据方程式中各个物理量之间的关系式进行计算.
解答 测得某废腐蚀液中含CuCl2 1.5mol/L、FeCl2 3.0mol/L、FeCl3 1.0mol/L、HCl 3.0mol/L,取废腐蚀液200mL,向废腐蚀液中加入过量Fe粉,发生的反应有CuCl2+Fe=Cu+FeCl2、2FeCl3+Fe=3FeCl2、Fe+2HCl=FeCl2+H2↑,然后过滤得到Cu、Fe和FeCl2溶液,向滤液中通入氯气发生反应2FeCl2+Cl2=2FeCl3,从而得到氯化铁溶液;
(1)铜与盐酸不反应,铁粉与盐酸反应生成氯化亚铁,所以加入盐酸可以除去铜中的铁粉,故答案为:HCl;
(2)固体KClO3与浓HCl反应生成氯气和氯化钾、水,化学方程式:KClO3+6HCl(浓)=3Cl2↑+KCl+3H2O,故答案为:KClO3+6HCl(浓)=3Cl2↑+KCl+3 H2O;
(3)缓慢旋动分液漏斗的活塞,调节液体滴下的速度,可以控制生成氯气速度,故答案为:缓慢旋动分液漏斗的活塞,调节液体滴下的速度;
(4)加入铁粉后,分别于氯化铜、氯化铁、盐酸反应,
Fe+CuCl2=FeCl2+Cu
0.3mol 1.5mol•L-1×0.2L 0.3mol
Fe+2FeCl3=3FeCl2
0.1mol 1.0mol•L-1×0.2L 0.3mol
Fe+2HCl=FeCl2+H2↑
0.3mol 3.0mol•L-1×0.2L 0.3mol
共消耗Fe粉的物质的量为0.3mol+0.1mol+0.3mol=0.7mol,质量为0.7mol×56g/mol=39.2g,
Cl2+2FeCl2=2FeCl3
A 0.75mol 1.5mol
所以共消耗氯气的物质的量为0.75mol,
故答案为:39.2;0.75.
点评 本题考查物质分离和提纯,涉及除杂、化学方程式的有关计算、氧化还原反应、实验基本操作等知识点,为高频考点,明确物质性质、反应原理、基本实验操作方法即可解答,注意化学用语的正确运用,为易错点.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 离子 | 开始沉淀时的pH | 完全沉淀时的pH |
| Fe2+ | 6.34 | 9.7 |
| Fe3+ | 1.48 | 3.2 |
| Zn2+ | 6.2 | 8.0 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 能使甲基橙变红的溶液中:Fe2+、Al3+、NO3-、Cl-、S2- | |
| B. | 在pH=11的溶液中:Na+、AlO2-、NO3-、S2-、SO32- | |
| C. | 室温下,由水电离的c(H+)=10-10mol/L的溶液中:Cl-、HCO3-、NO3-、NH4+、F- | |
| D. | 0.1 mol•L-1 FeCl3溶液中:K+、Na+、AlO2-、SCN- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
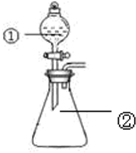 用如图所示装置进行下列实验:将①中溶液滴入②锥形瓶中,预测的现象与实际相符的是( )
用如图所示装置进行下列实验:将①中溶液滴入②锥形瓶中,预测的现象与实际相符的是( ) | 选项 | ①中物质 | ②中物质 | 预测②中的现象 |
| A. | 稀盐酸 | 碳酸钠与氢氧化钠的混合溶液 | 立即产生气泡 |
| B. | 浓硝酸 | 用砂纸打磨过的铝条 | 产生红棕色气体 |
| C. | 氯化铝溶液 | 浓氢氧化钠溶液 | 产生大量白色沉淀 |
| D. | SO2饱和溶液 | 高锰酸钾酸性溶液 | 溶液逐渐褪色 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 金属氧化物 氧化铁 FeO | |
| B. | 非金属氧化物 二氧化硫 SO2 | |
| C. | 碱性氧化物 过氧化钠 Na2O2 | |
| D. | 碱 纯碱 Na2CO3 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氢化物的稳定性:HF>HCl>H2S>PH3>SiH4 | |
| B. | 离子的还原性:S2->Cl->Br->I- | |
| C. | 酸性:H2SO4>H3PO4>H2CO3>HClO | |
| D. | 金属性:Be<Mg<Ca<K |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
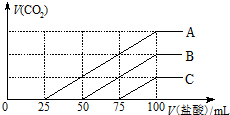 浓度相同的NaOH溶液各100ml 倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐渐加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示.下列判断正确的是( )
浓度相同的NaOH溶液各100ml 倒入A、B、C三个烧杯中,分别向三份溶液中通入不等量的CO2,充分反应后,再向三份所得溶液中逐渐加入0.2mol/L的盐酸,产生CO2的体积与所加盐酸体积之间关系如下图所示.下列判断正确的是( )| A. | 原NaOH溶液的浓度为0.2mol/L | |
| B. | B烧杯中通入CO2体积为448ml | |
| C. | 通入CO2后,不能确定A烧杯中的溶质 | |
| D. | 通入CO2后,C烧杯中溶质成分的物质的量之比为n(NaOH):n(Na2CO3)=2:1 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com