
| A. | 氢氧化钠、盐酸都为强电解质 | |
| B. | 铁生锈、食物腐败都有氧化反应发生 | |
| C. | 糖类、蛋白质都为高分子化合物 | |
| D. | 一氯甲烷、二氧化碳都是极性分子 |
科目:高中化学 来源: 题型:解答题
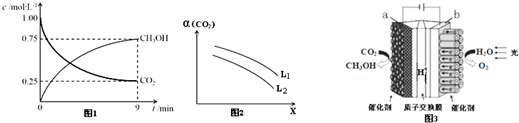
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若原料完全反应生成上述产物,CH2CH2Br与NH3的物质之比为2:1 | |
| B. | 该反应属于取代反应 | |
| C. | CH2CH2Br与HBr均属于电解质 | |
| D. | CH2CH2Br难溶于水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 实验室配制480 mL 0.1 mol/L NaOH溶液,需要准确称量NaOH 1.920 g | |
| B. | 学生实验测定硫酸铜晶体中结晶水含量时,通常至少称量4次 | |
| C. | 酸碱中和滴定实验中只能用标准液滴定待测液 | |
| D. | 分液时,分液漏斗中下层液体从下口放出后,换一容器再从下口放出上层液体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
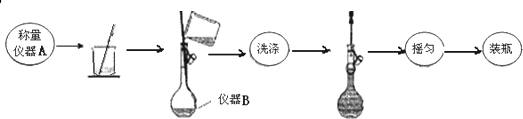

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:
工业合成气(CO2、CO、H2)在催化剂作用下,于密闭容器中同时存在如下三个反应:| A. | 由图可知:Pl<P2 | |
| B. | 升高温度反应Ⅱ的平衡常数减小 | |
| C. | 恒压绝热下向反应器中加Ar(g).反应Ⅲ一定不移动 | |
| D. | 其它条件不变,起始时改变CO和CO2比例,平衡时CO转化率不变 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
A、B、C、D、E、F、G、H八种主族元素分布在三个不同的短周期,它们在周期表中位置如下:
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
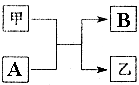 单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:
单质A、B与化合物甲、乙有如图所示的转化关系(必要的反应条件未标出),回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com