现有一份Fe
2O
3与CuO的混合物,欲用CO还原法测定其中Fe
2O
3的质量分数ω(Fe
2O
3).制取CO可用乙二酸晶体在浓硫酸作用下加热生成CO、CO
2,然后用纯净的CO还原混合物.实验中测定以下数据:反应前混合物的质量m
1;反应后混合物的质量m
2.
可供选择的实验用品有:18mol/LH
2SO
4溶液、6mol/LBa(OH)
2溶液、蒸馏水、乙二酸晶体、NaOH溶液、CaCO
3、NaCl、Fe
2O
3与CuO的混合物,常用仪器等
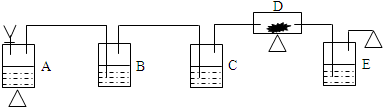
(1)请设计并绘制一个实验装置示意图(假定每步反应和杂质吸收均是完全的).各仪器分别用下列代号表示(玻璃管口之间的联结胶管不必画出):
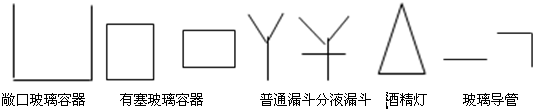
并用A、B、C…依次给各仪器标号.
(2)请写出示意图上用A、B、C…标示的各容器中盛放的物质的名称:
A
B
C
D
E
…
(3)请用m
1和m
2表示求ω(Fe
2O
3)的计算式:ω(Fe
2O
3)=
.


 ;
;

 同步练习强化拓展系列答案
同步练习强化拓展系列答案