
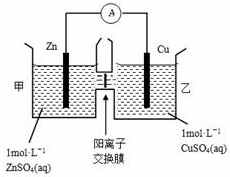
| A. | 铜电极上发生氧化反应 | |
| B. | 电池工作一段时间后,乙池溶液的总质量增加 | |
| C. | 电池工作一段时间后,乙池的c(Zn2+)>c(SO42-) | |
| D. | 阴、阳离子分别通过交换膜向负极和正极移动,保持溶液中电荷平衡 |
分析 由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn发生氧化反应,为负极,Cu电极上发生还原反应,为正极,阳离子交换膜只允许阳离子和水分子通过,两池溶液中硫酸根浓度不变,随反应进行,甲池中的Zn2+通过阳离子交换膜进入乙池,以保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大.
解答 解:A.由图象可知,该原电池反应式为:Zn+Cu2+=Zn2++Cu,Zn为负极,发生氧化反应,Cu为正极,发生还原反应,故A错误;
B.甲池中的Zn2+通过阳离子交换膜进入乙池,乙池中发生反应:Cu2++2e-=Cu,保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,而Zn的摩尔质量大于Cu,故乙池溶液总质量增大,故B正确;
C.阳离子交换膜只允许阳离子和水分子通过,故两池中c(SO42-)不变,以保持溶液呈电中性,进入乙池的Zn2+与放电的Cu2+的物质的量相等,所以乙池的c(Zn2+)≤c(SO42-),故C错误;
D.甲池中的Zn2+通过阳离子交换膜进入乙池,而阴离子不能通过,以保持溶液电荷守恒,故D错误,
故选:B.
点评 本题考查原电池工作原理,为高频考点,侧重于学生的分析能力的考查,注意把握原电池的工作原理,题目比较基础,注意阳离子交换膜不允许阳离子通过,C选项利用电荷守恒分析.


科目:高中化学 来源: 题型:选择题
| A. | ①③⑤⑥⑦ | B. | ②④⑥⑦ | C. | ④⑤⑥ | D. | ①③④⑤⑥⑦ |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | 与足量的澄清石灰水反应的现象不同 | |
| B. | 通入BaCl 2溶液时现象相同 | |
| C. | 通入Ba(NO3)₂溶液时现象相同 | |
| D. | 通入石蕊溶液时现象相同 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
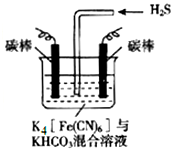 [Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )
[Fe(CN)6]3-可将气态废弃物中的硫化氢转化为可利用的硫,自身还原为[Fe(CN)6]4-.工业上常采用如图所示的电解装置,通电电解,然后通入H2S加以处理.下列说法不正确的是( )| A. | 整个过程中需要不断补充K4[Fe(CN)6]与KHCO3 | |
| B. | 电解时阴极反应式为:2HCO3-+2 e-═H2↑+2CO32- | |
| C. | 当电解过程中有22.4L标准状况下的H2生成时,溶液中有32gS析出(溶解忽略不计) | |
| D. | 电解时阳极反应式为[Fe(CN)6]4--e-═[Fe(CN)6]3- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )
纽扣电池可用于计算器、电子表等的电源.有一种纽扣电池,其电极分别为Zn和Ag2O,以KOH溶液为电解质溶液,电池的总反应为Zn+Ag2O═2Ag+ZnO.关于该电池的叙述不正确的是( )| A. | 作用时电子由Zn极经外电路流向Ag2O极,Zn是负极 | |
| B. | 使用时电子由Ag2O极经外电路流向Zn极,Ag2O是负极 | |
| C. | 正极的电极反应为Ag2O+2e-+H2O═2Ag+2OH- | |
| D. | Zn极发生氧化反应,Ag2O极发生还原反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.
甲醇(CH3OH)是一种重要的化工原料,也是一种比较理想的燃料.甲醇在各个领域有着广泛的应用.
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 高温、高压 | B. | 适宜的温度、高压、催化剂 | ||
| C. | 低温、低压 | D. | 高温、高压、催化剂 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com