
| A. | CO2通入到 CaCl2溶液中 | |
| B. | NH3通入 AlCl3溶液中 | |
| C. | 用脱脂棉包裹Na2O2粉末向其中通入适量二氧化碳 | |
| D. | 稀盐酸滴加到Fe(OH)3胶体中 |
分析 A.盐酸酸性大于碳酸,CO2通入到 CaCl2溶液中不发生反应;
B.NH3通入 AlCl3溶液中生成氢氧化铝白色沉淀;
C.过氧化钠和二氧化碳气体反应生成碳酸钠和氧气,反应放热脱脂棉燃烧;
D.氢氧化铁胶体中加入电解质溶液,先发生胶体聚沉后沉淀溶解;
解答 解:A.盐酸酸性大于碳酸,CO2通入到 CaCl2溶液中不发生反应,过程中始终无明显现象,故A正确;
B.氢氧化铝是两性氢氧化物溶于强酸强碱,不溶于弱酸弱碱,NH3通入 AlCl3溶液中生成氢氧化铝白色沉淀,Al3++3NH3•H2O=Al(OH)3↓+3NH4+,故B错误;
C.过氧化钠和二氧化碳气体反应生成碳酸钠和氧气,反应放热脱脂棉燃烧,有明显现象,故C错误;
D.稀盐酸滴加到Fe(OH)3胶体中,先发生胶体聚沉,继续滴入氢氧化铁沉淀溶解,有明显现象,故D错误;
故选A.
点评 本题考查了物质性质的分析,主要是生成产物和反应现象的判断,注意物质的特殊性掌握,题目较简单.


科目:高中化学 来源: 题型:填空题
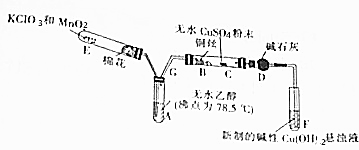
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
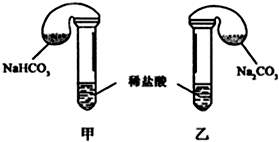
| 试剂用量 | 实验现象 (气球体积变化) | 分析原因 | |
| 第 ① 组 | 42g NaHCO3 53g Na2CO3 300mL4mol/L盐酸 | 甲中气球与乙中 气球的体积相等 | 甲、乙盐酸均过量 n(NaHCO3)=n (Na2CO3) V甲(CO2)=V乙(CO2) |
| 第 ② 组 | 42g NaHCO3 53g Na2CO3 300mL3mol/L盐酸 | 甲中气球体积大于乙中气球的体积(填“大于”或“小于” 或“等于”) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原子半径A>B>D>C | B. | 原子序数a>b>c>d | ||
| C. | 离子半径D>C>B>A | D. | 金属性B>A,非金属性D>C |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
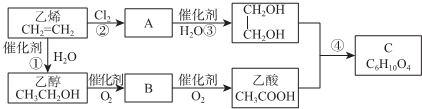
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 时间/s | 0 | 2 | 4 | 6 | 8 | 10 |
| c(NO)/mol•L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
| c(CO)/mol•L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
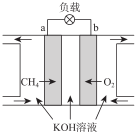
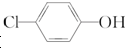 )的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )
)的废水可以利用微生物电池除去,其原理如图所示,下列说法错误的是( )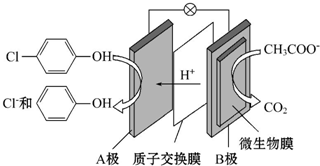
| A. | 该装置能将化学能转化为电能 | |
| B. | A极为正极 | |
| C. | B极上发生氧化反应 | |
| D. | 每有1 mol CH3COO-被氧化,就有8 mol电子通过整个电路 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com