
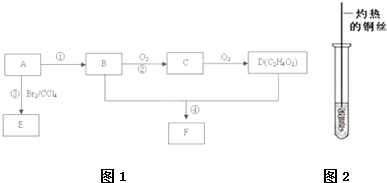
| 浓硫酸 |
| 170℃ |
| 浓硫酸 |
| 170℃ |
| Cu |
| △ |
| Cu |
| △ |


科目:高中化学 来源: 题型:
| A、铁与稀盐酸反应:2Fe+6H+=2Fe3++3H2↑ |
| B、铝粉投入到NaOH溶液中:Al+2OH-═AlO2-+H2↑ |
| C、氯化铁溶液中加入铁粉:2Fe3++Fe═3Fe2+ |
| D、AlCl3溶液中加入足量的氨水:Al3++3OH-═Al(OH)3↓ |
查看答案和解析>>
科目:高中化学 来源: 题型:
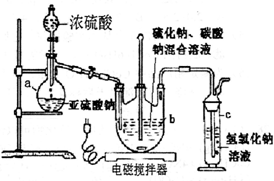 硫代硫酸钠(Na2S2O3?5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热易分解.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:实验具体操作步骤为:
硫代硫酸钠(Na2S2O3?5H2O)俗名“大苏打”,又称为“海波”.它易溶于水,难溶于乙醇,加热易分解.工业上常用亚硫酸钠法、硫化碱法等制备.某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:实验具体操作步骤为:| 实验序号 | 1 | 2 | 3 |
| N2aS2O3溶液体积(mL) | 19.8 | 20.02 | 21.18 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、c(Na+)>c(A-)>c(H+)>c(OH-) |
| B、c(Na+)>c(OH-)>c(A-)>c(H+) |
| C、c(Na+)+c(H+)=c(A-)+c(OH-) |
| D、c(Na+)+c(OH-)=c(A-)+c(H+) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 实验目的 | 实验方法 |
| 除去 NaHC03溶液中少量的 Na2C03 | |
| 检验自来水中是否含有Cl- | |
| 证明 Na2C03溶液呈碱性 | |
| 除去FeCl3溶液中少量的FeCl2 |
查看答案和解析>>
科目:高中化学 来源: 题型:

查看答案和解析>>
科目:高中化学 来源: 题型:
| A、铝片长期放置在不密封的纸盒里 |
| B、氢氟酸贮放在玻璃瓶里 |
| C、少量的金属钠应保存在煤油中 |
| D、盛氢氧化钠溶液的试剂瓶用橡胶塞 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com