
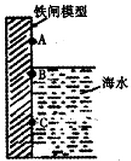
 铁闸中的A、B、C三点中,C点的电极反应方程式为Fe-2e-=Fe2+将此铁闸与电源的负极相连可起到保护该铁闸的作用.对铁制品进行钝化处理可提高其抗腐蚀能力,下面是处理过程中的一个反应的方程式为:请配平该反应方程式.
铁闸中的A、B、C三点中,C点的电极反应方程式为Fe-2e-=Fe2+将此铁闸与电源的负极相连可起到保护该铁闸的作用.对铁制品进行钝化处理可提高其抗腐蚀能力,下面是处理过程中的一个反应的方程式为:请配平该反应方程式.分析 (1)C点处Fe失电子生成亚铁离子;与外接电源的负极相连作阴极被保护;
根据元素化合价变化,结合电子守恒、原子守恒分析化学方程式中化学计量数;
(2)FeCl3和H2S发生氧化还原反应,H2S具有还原性能被铁离子氧化为硫沉淀,Fe3+会被还原为Fe2+;
(3)I-的还原性强于Fe2+,根据加入的双氧水量少来分析;检验碘单质的生成用淀粉;I-在酸性条件下被双氧水氧化为I2,双氧水被还原为水,据此分析;
(4)向浓度均为0.1mol•L-1的FeSO4和CuSO4的混合溶液中滴加Na2S溶液,当两种金属离子沉淀完全时,有:c(Fe2+)c(S2-)=Ksp(FeS)=6.5×10-18;c(Cu2+)c(S2-)=Ksp(CuS)=1.3×10-36,据此分析.
解答 解:(1)铁闸在海水中发生吸氧腐蚀,C点铁闸做负极,Fe失电子生成亚铁离子,故电极反应为:Fe-2e-=Fe2+;钢铁的防护有牺牲阳极的阴极保护法和外接电源的阴极保护法,故与外接电源的负极相连.即铁闸作阴极会被保护;
在此氧化还原反应中,Na2FeO2化合价由+2价升为Na2Fe2O4的+3价,当2molNa2FeO2参与反应时,失去2mol电子;NaNO2做氧化剂,化合价由+3价将为NH3的-3价,当1molNaNO2参与反应时,失去6mol电子,根据得失电子数守恒可知,Na2FeO2的计量数为6,Na2Fe2O4的计量数为3,NaNO2的计量数为1,NH3的计量数为1,然后根据质量守恒可知,H2O的计量数为5,NaOH的计量数为7,反应为6Na2FeO2+NaNO2+5H2O═3Na2Fe2O4+NH3↑+7NaOH,
故答案为:Fe-2e-=Fe2+;负;6;1;5;3;1;7
(2)FeCl3和H2S发生氧化还原反应,H2S具有还原性能被铁离子氧化为硫沉淀,由于是在酸性条件下,而不能生成FeS沉淀,故离子方程式为:2Fe3++H2S=2Fe2++S↓+2H+;故答案为:2Fe3++H2S=2Fe2++S↓+2H+;
(3)I-的还原性强于Fe2+,由于加入的双氧水量少,故双氧水先氧化I-生成I2,故溶液变为浅黄色可能是有碘单质生成;检验碘单质的生成用淀粉;I-在酸性条件下被双氧水氧化为I2,双氧水被还原为水,根据得失电子数守恒和质量守恒可知离子方程式为:2I-+H2O2+2H+=I2+2H2O,故答案为:I2;淀粉;2I-+H2O2+2H+=I2+2H2O;
(4)向浓度均为0.1mol•L-1的FeSO4和CuSO4的混合溶液中滴加Na2S溶液,当两种金属离子沉淀完全时,有:c(Fe2+)c(S2-)=Ksp(FeS)=6.5×10-18;c(Cu2+)c(S2-)=Ksp(CuS)=1.3×10-36,故有:c(Fe2+):c(Cu2+)=$\frac{Ksp(FeS)}{Ksp(CuS)}$=$\frac{6.5×1{0}^{-18}}{1.3×1{0}^{-36}}$=5×10-18,故答案为:5×10-18.
点评 本题考查较为综合,涉及金属的电化学腐蚀、离子方程式的书写、难溶电解质的溶解平衡等问题,为高考常见题型,侧重于学生的分析能力的考查,注意把握答题思路,难度中等.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:选择题
| A. | 2种 | B. | 3种 | C. | 6种 | D. | 9种 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 0.4mol | B. | 0.55mol | C. | 0.6mol | D. | 0.65mol |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液化石油气、汽油、柴油和润滑油的主要成分都是碳氢化合物 | |
| B. | 乙烯、氯乙烯和聚氯乙烯都能因发生加成反应而使溴水褪色 | |
| C. | 用溴水既可以鉴别甲烷和乙烯.也可以除去甲烷中的乙烯 | |
| D. | 可以通过灼烧时的特殊气味来鉴别蛋自质 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Ca2+的结构示意图为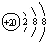 | B. | CO2分子的比例模型示意图: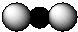 | ||
| C. | 水合钠离子: | D. | 次氯酸的电子式: |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 添加A物质 | B. | 升高体系温度 | C. | 及时分离出C物质 | D. | 减少B物质 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com