
 £®
£®·ÖĪö £Ø1£©A”¢B”¢C”¢D”¢EŹĒĻąĮŚČżøöÖÜĘŚÖŠµÄĪåÖÖŌŖĖŲ£¬¢Ł³żAĶā£¬ø÷ŌŖĖŲŌ×ÓµÄÄŚ²ć¾łŅŃĢīĀśµē×Ó£¬ŌņAĪŖHŌŖĖŲ£»B”¢C”¢DŹōĶ¬Ņ»ÖÜĘŚ£¬¼““¦ÓŚµŚ¶žÖÜĘŚ£¬BµÄ×īĶā²ćÓŠ4øöµē×Ó£¬¹ŹBĪŖĢ¼ŌŖĖŲ£¬A”¢EŌŚÖÜĘŚ±ķÖŠ“¦ÓŚĶ¬Ņ»×ŻŠŠ£¬æÉĶĘÖŖEĪŖNaŌŖĖŲ£¬ÓÉAÓėB£¬BÓėC¶¼ÄÜÉś³ÉĘųĢ¬·Ē¼«ŠŌ·Ö×ӵĻÆŗĻĪļ£¬æÉÖŖCĪŖOŌŖĖŲ£¬ŠĪ³ÉµÄ·Ē¼«ŠŌ·Ö×ÓĪŖCH4”¢CO2£¬DÓėEÉś³ÉĄė×Ó»ÆŗĻĪļ£¬ĘäĄė×ӵĵē×Ó²ć½į¹¹ĻąĶ¬£¬ŌņDĪŖFŌŖĖŲ£»
£Ø2£©CĪŖOŌŖĖŲ£¬Ō×ÓŗĖĶāÓŠ2øöµē×Ó²ć£¬ø÷²ćµē×ÓŹżĪŖ2”¢6£¬Ö÷×åŌŖĖŲÖÜĘŚŹż=µē×Ó²ćŹż”¢Ö÷×å×åŠņŹż=×īĶā²ćµē×ÓŹż£»
£Ø3£©ÓÉÓŚ£Øn-3£©g£¼£Øn-2£©f£¼£Øn-1£©d£¼n s£¼n p£¬¹ŹµŚ°ĖÖÜĘŚŗ¬ÓŠs”¢p”¢d”¢f”¢gÄܼ¶£¬ø÷Äܼ¶ČŻÄɵē×ÓŹżÄæÖ®ŗĶĪŖøĆøĆÖÜĘŚČŻÄÉŌŖĖŲÖÖŹż£»
£Ø4£©Ō×ÓŗĖĶā³öĻÖµŚŅ»øö6fµē×ÓµÄŌŖĖŲµÄŌ×ÓĶāĪ§µē×ÓÅŲ¼ŹĒ5g186f18s2£¬øł¾ŻŗĖĶāµē×ÓÅŲ¼Ź½£¬Ó¦øĆŹĒ£ŗ[118]5g186f18s2£»
£Ø5£©µŚĘßÖÜĘŚĮć×åŌŖĖŲµÄŌ×ÓŠņŹżŹĒ118£¬ĖłŅŌ114ŗÅŌŖĖŲŌŚ“ĖŌŖĖŲµÄ×ó±ß£¬Ó¦øĆŹĒµŚĘßÖÜĘŚ¢ōA×åŌŖĖŲ£®
½ā“š ½ā£ŗ£Ø1£©A”¢B”¢C”¢D”¢EŹĒĻąĮŚČżøöÖÜĘŚÖŠµÄĪåÖÖŌŖĖŲ£¬¢Ł³żAĶā£¬ø÷ŌŖĖŲŌ×ÓµÄÄŚ²ć¾łŅŃĢīĀśµē×Ó£¬ŌņAĪŖHŌŖĖŲ£»B”¢C”¢DŹōĶ¬Ņ»ÖÜĘŚ£¬¼““¦ÓŚµŚ¶žÖÜĘŚ£¬BµÄ×īĶā²ćÓŠ4øöµē×Ó£¬¹ŹBĪŖĢ¼ŌŖĖŲ£¬A”¢EŌŚÖÜĘŚ±ķÖŠ“¦ÓŚĶ¬Ņ»×ŻŠŠ£¬æÉĶĘÖŖEĪŖNaŌŖĖŲ£¬ÓÉAÓėB£¬BÓėC¶¼ÄÜÉś³ÉĘųĢ¬·Ē¼«ŠŌ·Ö×ӵĻÆŗĻĪļ£¬æÉÖŖCĪŖOŌŖĖŲ£¬ŠĪ³ÉµÄ·Ē¼«ŠŌ·Ö×ÓĪŖCH4”¢CO2£¬DÓėEÉś³ÉĄė×Ó»ÆŗĻĪļ£¬ĘäĄė×ӵĵē×Ó²ć½į¹¹ĻąĶ¬£¬ŌņDĪŖFŌŖĖŲ£¬
¹Ź“š°øĪŖ£ŗH£»C£»O£»F£»
£Ø2£©CĪŖOŌŖĖŲ£¬Ō×ÓŗĖĶāÓŠ2øöµē×Ó²ć£¬ø÷²ćµē×ÓŹżĪŖ2”¢6£¬Ō×Ó½į¹¹Ź¾ŅāĶ¼ĪŖ £¬“¦ÓŚµŚ¶žÖÜ¢öA×壬
£¬“¦ÓŚµŚ¶žÖÜ¢öA×壬
¹Ź“š°øĪŖ£ŗ¶ž”¢¢öA£» £»
£»
£Ø3£©ÓÉÓŚ£Øn-3£©g£¼£Øn-2£©f£¼£Øn-1£©d£¼n s£¼n p£¬¹ŹµŚ°ĖÖÜĘŚŗ¬ÓŠs”¢p”¢d”¢f”¢gÄܼ¶£¬ø÷Äܼ¶ČŻÄɵē×ÓŹżÄæÖ®ŗĶĪŖøĆøĆÖÜĘŚČŻÄÉŌŖĖŲÖÖŹż£¬¼“ČŻÄÉŌŖĖŲÖÖŹżĪŖ£ŗ1”Į2+3”Į2+5”Į2+7”Į2+9”Į2=50£¬
¹Ź“š°øĪŖ£ŗ50£»
£Ø4£©Ō×ÓŗĖĶā³öĻÖµŚŅ»øö6fµē×ÓµÄŌŖĖŲµÄŌ×ÓĶāĪ§µē×ÓÅŲ¼ŹĒ5g186f18s2£¬øł¾ŻŗĖĶāµē×ÓÅŲ¼Ź½£¬Ó¦øĆŹĒ£ŗ[118]5g186f18s2£¬ŹōÓŚ139ŗÅŌŖĖŲ£¬¹Ź“š°øĪŖ£ŗ139£»
£Ø5£©µŚĘßÖÜĘŚĮć×åŌŖĖŲµÄŌ×ÓŠņŹżŹĒ118£¬ĖłŅŌ114ŗÅŌŖĖŲŌŚ“ĖŌŖĖŲµÄ×ó±ß£¬Ó¦øĆŹĒµŚĘßÖÜĘŚ£¬¢ōA×åŌŖĖŲ£¬ŹōÓŚpĒųŌŖĖŲ£¬¼Ūµē×ÓÅŲ¼ŹĒ£ŗ7s27p2£¬
¹Ź“š°øĪŖ£ŗĘߣ»¢ōA£»7s27p2£®
µćĘĄ ±¾ĢāŹĒ¶Ō½į¹¹»ÆѧÖŖŹ¶µÄ漲飬²ąÖŲŌŖĖŲŌ×Ó¹ģµĄÄܼ¶µČÖŖŹ¶æ¼²é£¬½ĻŗƵÄæ¼²éѧɜ·ÖĪöĶĘĄķÄÜĮ¦£¬ÄŃ¶Č½Ļ“ó£®


 ŹżŃ§°ĀČüŹī¼ŁĢģĢģĮ·ÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø
ŹżŃ§°ĀČüŹī¼ŁĢģĢģĮ·ÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø ÄĻ“ó½ĢøØĒĄĻČĘšÅÜŹī¼ŁĻĪ½Ó½Ģ³ĢÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø
ÄĻ“ó½ĢøØĒĄĻČĘšÅÜŹī¼ŁĻĪ½Ó½Ģ³ĢÄĻ¾©“óѧ³ö°ęÉēĻµĮŠ“š°ø
| Äź¼¶ | øßÖŠæĪ³Ģ | Äź¼¶ | ³õÖŠæĪ³Ģ |
| øßŅ» | øßŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” | ³õŅ» | ³õŅ»Ćā·ŃæĪ³ĢĶĘ¼ö£” |
| ø߶ž | ø߶žĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õ¶ž | ³õ¶žĆā·ŃæĪ³ĢĶĘ¼ö£” |
| øßČż | øßČżĆā·ŃæĪ³ĢĶĘ¼ö£” | ³õČż | ³õČżĆā·ŃæĪ³ĢĶĘ¼ö£” |
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| A£® | HR | B£® | H2R | C£® | RH3 | D£® | RH4 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ¶ąŃ”Ģā
| A£® | ±ź×¼×“æöĻĀ£¬22.4L H2ŗ¬ÓŠµÄŌ×ÓŹżĪŖNA | |
| B£® | µČÖŹĮæµÄO2ŗĶO3ÖŠĖłŗ¬µÄŃõŌ×ÓŹżĻąµČ | |
| C£® | Ķ¬ĪĀĶ¬Ń¹ĻĀ£¬ĻąĶ¬Ģå»żµÄH2ŗĶO2£¬ĘäÖŹĮæ±ČĪŖ1£ŗ16 | |
| D£® | 28g COÓė22.4L CO2Ėłŗ¬µÄĢ¼Ō×ÓŹżĻąµČ |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā
 ijĶ¬Ń§ÓĆĻĀĮŠ×°ÖĆ£Ø¹Ģ¶Ø”¢¼ÓČČŅĒĘ÷ŗĶĻš½ŗ¹ÜĀŌ£©½ųŠŠÓŠ¹Ų°±ĘųÖĘČ”µÄŹµŃéĢ½¾æ£¬»Ų“šĻĀĮŠĪŹĢā£®
ijĶ¬Ń§ÓĆĻĀĮŠ×°ÖĆ£Ø¹Ģ¶Ø”¢¼ÓČČŅĒĘ÷ŗĶĻš½ŗ¹ÜĀŌ£©½ųŠŠÓŠ¹Ų°±ĘųÖĘČ”µÄŹµŃéĢ½¾æ£¬»Ų“šĻĀĮŠĪŹĢā£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗŃ”ŌńĢā
| »Æѧ¼ü | A-A | B-B | A-B |
| Éś³É1mol»Æѧ¼üŹ±·Å³öµÄÄÜĮæ | 436kJ•mol-1 | 243kJ•mol-1 | 431kJ•mol-1 |
| A£® | $\frac{1}{2}$A2£Øg£©+$\frac{1}{2}$B2£Øg£©ØTAB£Øg£©”÷H=-91.5 kJ•mol -1 | |
| B£® | A2£Øg£©+B2£Øg£©ØT2AB£Øg£©”÷H=-183 kJ•mol -1 | |
| C£® | $\frac{1}{2}$A2£Øg£©+$\frac{1}{2}$B2ØTAB£Øg£©”÷H=+91.5 kJ•mol-1 | |
| D£® | 2AB£Øg£©ØTA2£Øg£©+B2£Øg£©”÷H=+183 kJ•mol-1 |
²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗ½ā“šĢā

 £®
£® £®
£® £®
£® Óė×ćĮæNaOHČÜŅŗ·“Ó¦Ź±£¬×ī¶ąĻūŗÄ4mol NaOH
Óė×ćĮæNaOHČÜŅŗ·“Ó¦Ź±£¬×ī¶ąĻūŗÄ4mol NaOH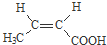 £®
£® £®
£®²éæ““š°øŗĶ½āĪö>>
æĘÄæ£ŗøßÖŠ»Æѧ Ą“Ō“£ŗ ĢāŠĶ£ŗĢīæÕĢā
| ĘšŹ¼ÅØ¶Č | ¼× | ŅŅ | ±ū |
| c£ØH2£©/mol/L | 0.010 | 0.020 | 0.020 |
| c£ØCO2£©/mol/L | 0.010 | 0.010 | 0.020 |
²éæ““š°øŗĶ½āĪö>>
°Ł¶ČÖĀŠÅ - Į·Ļ°²įĮŠ±ķ - ŹŌĢāĮŠ±ķ
ŗž±±Ź”»„ĮŖĶųĪ„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±ØĘ½ĢØ | ĶųÉĻÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | µēŠÅÕ©Ę¾Ł±Ø×ØĒų | É꥜Ź·ŠéĪŽÖ÷ŅåÓŠŗ¦ŠÅĻ¢¾Ł±Ø×ØĒų | ÉęĘóĒÖČؾŁ±Ø×ØĒų
Ī„·ØŗĶ²»Į¼ŠÅĻ¢¾Ł±Øµē»°£ŗ027-86699610 ¾Ł±ØÓŹĻä£ŗ58377363@163.com