
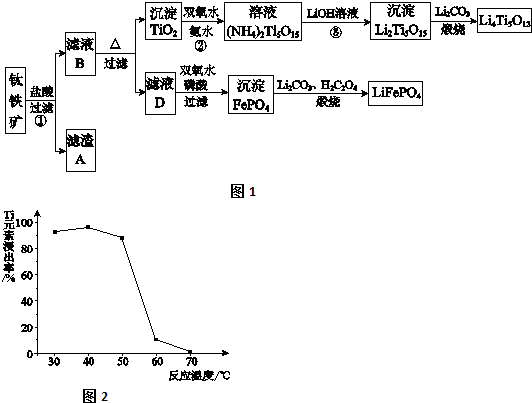
分析 铁矿石加入盐酸溶解过滤得到滤渣A为二氧化硅,滤液B为MgCl2、CaCL2,FeCl2、TiCl2,加热促进水解,过滤得到沉淀TiO2,加入过氧化氢和氨水反应得到(NH4)2Ti5O15,加入氢氧化锂溶液得到沉淀Li2Ti5O15加入碳酸锂煅烧得到钛酸锂Li4Ti5O12,滤液D加入过氧化氢氧化亚铁离子,加入磷酸得到沉淀磷酸铁,加入碳酸锂和草酸煅烧得到磷酸亚铁锂LiFePO4,
(1)根据反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O,不是非氧化还原反应,可以判断铁元素化合价为+2价;
(2)MgO、CaO、SiO2等杂质中,二氧化硅不溶于稀盐酸,成为滤渣A;
(3)根据流程图示,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀;
(4)二氧化钛与氨水、双氧水反应生成NH4)2Ti5O15,温度过高,双氧水和氨水都容易分解;
(5)反应3是(NH4)2Ti5O15与强氧化锂反应生成Li2Ti5O15沉淀和氨水;
(6)根据电子守恒找出双氧水与草酸的关系式,然后列式计算计算出17%双氧水与H2C2O4的质量比;
(7)充电时按照电解槽进行分析,阳极氧化阴极还原,写出阳极放电的电解方程式即可.
解答 解:(1)反应FeTiO3+4H++4Cl-=Fe2++TiOCl42-+2H2O中,不是非氧化还原反应,可以判断铁元素化合价为+2价,
故答案为:+2;
(2)由于杂质中二氧化硅不溶于盐酸,所以滤渣A成分是二氧化硅,
故答案为:SiO2;
(3)根据流程可知,TiOCl42-在溶液中加热与水反应生成二氧化钛沉淀,反应的离子方程式为:TiOCl42-+H2O=TiO2↓+2H++4Cl-,
故答案为:TiOCl42-+H2O=TiO2↓+2H++4Cl-;
(4)由于二氧化钛与氨水、双氧水反应生成NH4)2Ti5O15时,温度过高,双氧水和氨水都容易分解,所以反应温度过高时,Ti元素浸出率下降,
故答案为:温度过高时,反应物氨水(或双氧水)受热易分解;
(5)根据流程图示可知,反应3是(NH4)2Ti5O15与强氧化锂反应生成Li2Ti5O15沉淀和氨水,反应的化学方程式为:(NH4)2Ti5O15+2 LiOH=Li2Ti5O15↓+2NH3•H2O(或2NH3+2H2O),
故答案为:(NH4)2Ti5O15+2 LiOH=Li2Ti5O15↓+2NH3•H2O(或2NH3+2H2O);
(6)根据电子守恒,氧化铁元素转移的电子就等于铁离子氧化草酸转移的电子数,
因此可得关系式:H2O2~H2C2O4,设双氧水质量为x,草酸质量为y,
34 90
x×17% y
34y=90×x×17%,x:y=20:9,
17%双氧水与H2C2O4的质量比为20:9,
故答案为:20:9;
(7)充电时,阳极发生氧化反应,LiFePO4失去电子生成FePO4,电极反应为:LiFePO4-e-=FePO4+Li+,
故答案为:LiFePO4-e-=FePO4+Li+.
点评 本题借助利用钛铁矿制备锂离子电池电极材料流程,考查了化合价判断、离子方程式书写、电极方程式书写、化学计算等知识,涉及的内容较多,综合性较强,充分考查了学生的综合能力,本题难度中等.


 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:选择题
| A. | 加入盐酸以除去硫酸钠中少量的碳酸钠杂质 | |
| B. | 用玻璃棒搅拌漏斗中的液体以加快反应速率 | |
| C. | 用稀硫酸和锌反应制氢气时加入少许硫酸铜以加快反应速率 | |
| D. | 在容量瓶中加入一定体积的水,再加入浓硫酸配制准确浓度的稀硫酸 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 液态HCl不导电,所以HCl不是电解质 | |
| B. | NH3溶于水形成的溶液能导电,所以NH3是电解质 | |
| C. | Cl2溶于水能导电,所以Cl2是电解质 | |
| D. | BaSO4在水溶液中难导电,但熔融下能导电所以BaSO4是电解质 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向50 mL 1 mol•L-1的盐酸中加入烧碱,水的KW不变 | |
| B. | NH4Cl和NH3•H2O混合液中,二者对对方的平衡都起了抑制作用 | |
| C. | 有两种弱酸HX和HY且酸性HX>HY,则体积和浓度相同的NaX和NaY溶液中有c(Y-)>c(X-)>c(OH-)>c(H+) | |
| D. | 常温下0.1mol•L-1的HA溶液中c(OH-)/c(H+)=10-8,则0.01 mol•L-1HA溶液中c(H+)=1×10-4mol•L-1 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下的33.6L氯气与足量铝充分反应,转移电子数为3NA | |
| B. | 由CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | 由2H和18O所组成的水11克,其中所含的中子数为4NA | |
| D. | 1 L浓度为l mol•L-1的Na2CO3溶液中含有NA个CO32- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓、稀HNO3分别与Cu反应比较浓、稀HNO3的氧化性强弱 | |
| B. | 向盛有1mL硝酸银溶液的试管中滴加NaCl溶液,至不再有沉淀生成,再向其中滴加Na2S溶液 说明一种沉淀能转化为另一种溶解度更小的沉淀 | |
| C. | 测定等浓度的HCl、HNO3两溶液的pH 比较Cl、N的非金属性强弱 | |
| D. | 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸 研究浓度对反应速率的影响 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com