
����Ŀ����1����ͼ�ĵ�ѭ������̬ϵͳ����ѭ������Ҫ���֣������Ӿ��˵�ѭ���е�����ת����
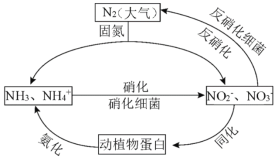
������˵����ȷ����_______������ĸ��ţ�
A.�̵������У�N2ֻ��������
B.����������Ҫ������������
C.�����������������ֲ��˹��̵��Ե�ѭ����ɵ�Ӱ��
D.ͬ�������������У�ʵ���˵�Ԫ����������л���֮���ת��
�ڷ����������У�CH3OH����Ϊ��Ӧ�Ļ�ԭ����1mol��ԭ��ʧȥ6mol���ӡ��뽫�÷�Ӧ�����ӷ���ʽ����������5CH3OH+��NO3��![]() ��_______+��_______+��_______+��_______��_____________
��_______+��_______+��_______+��_______��_____________
��2���о��������������NOx���Ͷ���������������������γ��йء�
����֪��SO2����SO3�ܷ�Ӧ����ʽ��2SO2(g)��O2(g)![]() 2SO3(g)��H����196.6kJ/mol
2SO3(g)��H����196.6kJ/mol
�˷�Ӧ��ͨ������������ɣ�2NO(g)��O2(g)![]() 2NO2(g)��H1����113kJ/mol
2NO2(g)��H1����113kJ/mol
NO2(g)��SO2(g)![]() SO3(g)��NO(g)��H2��_______��
SO3(g)��NO(g)��H2��_______��
��һ���¶��£���2L�����ܱ������г���NO2��SO2��1mol��5min�ﵽƽ�⣬��ʱ������NO2��NO��Ũ��֮��Ϊ1��3����NO2��ƽ��ת������_______��
��3���飨As���ǵ������ڢ�A��Ԫ�أ��仯������Ź㷺����;��
��AsH3���ȶ��Ա�NH3���ȶ���_______������ǿ��������������������ԭ�ӽṹ����ԭ��_______��
�ڳ��������������Ҫ�ɷ�ΪAs2S3���Ƴɽ�״��ͨ��O2����������H3AsO4�͵�����д��������Ӧ�Ļ�ѧ����ʽ_______��
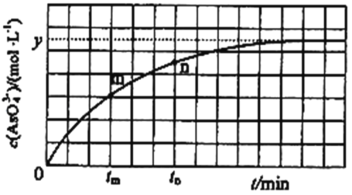
��298Kʱ����20mL3xmolL-1Na3AsO3��20mL3xmolL-1I2��20mLNaOH��Һ��ϣ�������Ӧ��AsO33-(aq)+I2(aq)+2OH-![]() AsO43-(aq)+2I-(aq)+H2O(l)����Һ��c(AsO43��)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ����ƽ��ʱ��Һ��pH=14����÷�Ӧ��ƽ�ⳣ��KΪ_______��
AsO43-(aq)+2I-(aq)+H2O(l)����Һ��c(AsO43��)�뷴Ӧʱ�䣨t���Ĺ�ϵ��ͼ��ʾ����ƽ��ʱ��Һ��pH=14����÷�Ӧ��ƽ�ⳣ��KΪ_______��
���𰸡�BCD 5CH3OH+6NO3-![]() N2��+4HCO3-+CO32-+8H2O ��41.8kJ/mol 75% �� N��Asλ��ͬһ���壬As�ĵ��Ӳ�����N�Ķ࣬ԭ�Ӱ뾶As��N�Ĵõ�������As��N�����ǽ�����As��N�����⻯��AsH3���ȶ��Ա�NH3�� 2As2S3+5O2+6H2O=4H3AsO4+6S
N2��+4HCO3-+CO32-+8H2O ��41.8kJ/mol 75% �� N��Asλ��ͬһ���壬As�ĵ��Ӳ�����N�Ķ࣬ԭ�Ӱ뾶As��N�Ĵõ�������As��N�����ǽ�����As��N�����⻯��AsH3���ȶ��Ա�NH3�� 2As2S3+5O2+6H2O=4H3AsO4+6S ![]()
��������
��1����A�������ڴ���������Ϊ����������ӡ���������ӣ�N�Ļ��ϼ����ߣ�������������N2����ԭ������A����
B��NH3ת����HNO2��������OԪ�أ���NH3����������������������ϸ�������·���������������Ҫ�����������룬��B��ȷ��
C�����������̣����ɵ�����������ṩ�������������������������ֲ��˹��̵��Ե�ѭ����ɵ�Ӱ�죬��C��ȷ��
D�����������Ƕ�ֲ�ﵰ��ת��Ϊ������笠����ӣ����л���ת��Ϊ���ͬ�������������У�ʵ���˵�Ԫ����������л���֮���ת������D��ȷ��
��ѡBCD��
�ڷ����������У�CH3OH����Ϊ��Ӧ�Ļ�ԭ����1mol��ԭ��ʧȥ6mol���ӡ�CH3OH����������ӷ�Ӧ���ɵ�����̼������ӡ�̼��������Ӻ�ˮ����Ӧ�����ӷ���ʽΪ��5CH3OH+6NO3-![]() N2��+4HCO3-+CO32-+8H2O���ʴ�Ϊ��5CH3OH+6NO3-
N2��+4HCO3-+CO32-+8H2O���ʴ�Ϊ��5CH3OH+6NO3-![]() N2��+4HCO3-+CO32-+8H2O��
N2��+4HCO3-+CO32-+8H2O��
��2���٢�.2SO2(g)��O2(g)![]() 2SO3(g)��H����196.6kJ��mol��1
2SO3(g)��H����196.6kJ��mol��1
��.2NO(g)��O2(g)![]() 2NO2(g)��H1����113kJ��mol��1
2NO2(g)��H1����113kJ��mol��1
��˹���ɼ��㣨��-����![]() �õ�NO2(g)��SO2(g)
�õ�NO2(g)��SO2(g)![]() SO3(g)��NO(g)��H2��-41.8 kJ��mol��1���ʴ�Ϊ��-41.8 kJ��mol��1��
SO3(g)��NO(g)��H2��-41.8 kJ��mol��1���ʴ�Ϊ��-41.8 kJ��mol��1��
��һ���¶��£���2 L�����ܱ������г���NO2��SO2��1 mol��5min�ﵽƽ�⣬��ʱ������NO2��NO��Ũ��֮��Ϊ1��3��������м�����ʽ�õ���������NO2�����ʵ���Ϊx��
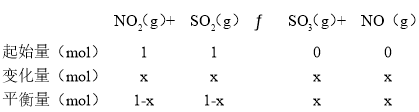
NO2��NO��Ũ��֮��Ϊ1��3�����ʵ���֮��=1��3����1-x����x=1��3��x=0.75mol��NO2��ƽ��ת����=![]() ��100%=75%��
��100%=75%��
�ʴ�Ϊ��75%��
��3���ٷǽ����ԣ�N>As��AsH3���ȶ��Ա�NH3���ȶ���������ԭ�ӽṹ����ԭ��N��Asλ��ͬһ���壬As�ĵ��Ӳ�����N�Ķ࣬ԭ�Ӱ뾶As��N�Ĵõ�������As��N�����ǽ�����As��N�����⻯��AsH3���ȶ��Ա�NH3����
�ڳ��������������Ҫ�ɷ�ΪAs2S3���Ƴɽ�״��ͨ��O2����������H3AsO4�͵�����ϵ���ת����ƽ�÷���ʽΪ��2As2S3+5O2+6H2O=4H3AsO4+6S��
�ʴ�Ϊ��2As2S3+5O2+6H2O=4H3AsO4+6S��
��������ʽ���£�
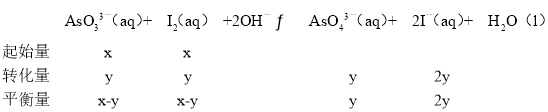
����ƽ�ⳣ������ʽK=![]() =
=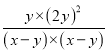 =
=![]() ���ʴ�Ϊ��
���ʴ�Ϊ��![]() ��
��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������(��)�γɵ�һ�������[Co(NH3)5NO2]Cl2���Ʊ��������£�
CoCl2��6H2O![]() [Co(NH3)5Cl]Cl2
[Co(NH3)5Cl]Cl2![]() [Co(NH3)5NO2]Cl2
[Co(NH3)5NO2]Cl2
(1)Co2+��̬��������Ų�ʽΪ___��
(2)�����[Co(NH3)5Cl]Cl2����Co3+�γ���λ����ԭ��Ϊ___(��Ԫ�ط���)��������[Co(NH3)5NO2]2+�������е�ԭ�ӵ��ӻ��������Ϊ___��
(3)NO![]() �Ŀռ乹��Ϊ___��������Ϊ�ȵ�����ķ���Ϊ___(д��ѧʽ)��
�Ŀռ乹��Ϊ___��������Ϊ�ȵ�����ķ���Ϊ___(д��ѧʽ)��
(4)H2O2��H2O��������������ܣ�����Ϊ���Ƕ��Ǽ��Է����⣬����Ϊ___��
(5)1mol[Co(NH3)5Cl]Cl2�к�����������ĿΪ___��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ����ǻ�ѧ�������һ���ش��ס�
(1)ij��ȤС��Ϊ�о�ԭ���ԭ���������ͼװ�á�a��b������ʱ���ձ��з�����Ӧ�����ӷ���ʽΪ__________��
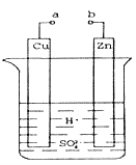
(2)a��b�õ������ӣ�Cu��Ϊԭ���_____(���������)�����缫��Ӧʽ��_______������_______(���������ԭ��)��Ӧ��
(3)��ʵ���У���ͬѧ���ֲ�����ͭƬ�������ݲ�����������пƬ��Ҳ���������壬����ԭ�������_______��
(4)�����пƬ����ʯī�����ֵ�����ָ�뼸������ƫת��ԭ��_____��
(5)��������ỻ������ͭ��Һ���²�____(�п������ͭ����)��֣�ԭ����____(�õ缫����ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ݷ�Ӧ8NH3+3Cl2=6NH4Cl+N2���ش��������⡣
(1)������______����ԭ��________
(2)��������______����ԭ����_______
(3)�������뻹ԭ�������ʵ���֮�ȣ�_________________________
(4)�õ����ŵķ�����ʾ�÷�Ӧ�ĵ���ת�������________________________
(5)��˫���ŵķ�����ʾ�÷�Ӧ�ĵ���ת�������_________________________
(6)����8mol NH3�μӷ�Ӧʱ��ת�Ƶĵ�����ĿΪ__________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1�������������� ��NaCl������Һ̬SO2 �۴����� �����ᱵ��ͭ �ƾ�(C2H5OH) ���ۻ���KNO3 ��NaOH��Һ �ᰱˮ �����������ʵ�����ش��������⣺
����ǿ����ʵ���________�� ����������ʵ���_______��������״̬���ܵ����������_________��
��2����ѧƽ���ƶ�ԭ��ͬ��Ҳ����������ƽ�⣬��֪�ڰ�ˮ�д�������ƽ�⣺NH3��H2O ![]() NH4����OH��
NH4����OH��
����ˮ�м���NH4Cl����ʱ��ƽ��____________�ƶ���(����ҡ�������)��c(OH��)____(�����С������ͬ)��
����ˮ�м���MgCl2����ʱ��ƽ��_____�ƶ���(����ҡ�������)�� c(NH4��)____(�����С��)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
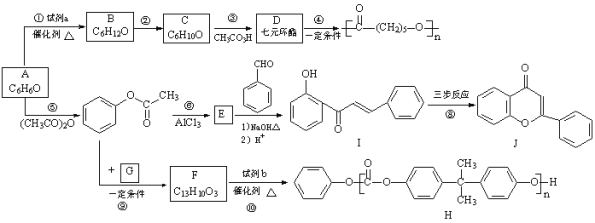
����Ŀ���ϳ�ҩ������������ͪ���м���E��˫��A�;�̼����H��·�ߣ�
��֪��i.![]()
ii.![]()
��1��A�Ľṹ��ʽ��__________��
��2���Լ�a��__________��
��3��Cֻ����һ�ֹ����ţ���Ӧ�ڵĻ�ѧ����ʽ��__________��
��4����Ӧ�ݵķ�Ӧ������__________��
��5��E�������__________��
��6������˵����ȷ���ǣ�__________������ĸ��ţ���
a����Ӧ����C����������Ӧ
b������FeCl3��Һ���鷴Ӧ����A�Ƿ�Ӧ��ȫ
c����Ӧ�ķ�Ӧ���������ﻥΪͬ���칹��
d����Ӧ�����Լ�b�Ľṹ��ʽ��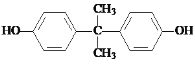
e����Ӧ�������ϾۺϷ�Ӧ�������˾���
��7��I��Jת����һ��·����ͼ����֪�м����2ת��ΪJ����ȥ��Ӧ��д���м����1���м����2�Ľṹ��ʽ��
![]()
����1��__________������2��__________��
��8��G�ķ���ʽΪC3H6O3��ֻ��һ�ֹ����ţ��Һ˴Ź�������ֻ��һ�ֻ�ѧ�������⣬��Ӧ��Ļ�ѧ����ʽ��__________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ΪԪ�����ڱ���һ���֣���ش��й����⣺
��A | ��A | ��A | ��A | ��A | ��A | ��A | 0 | |
2 | �� | �� | ||||||
3 | �� | �� | �� | �� | �� | �� | ||
4 | �� |
(1)��������õĽ�����___________���ǽ�������ǿ��Ԫ����____________������дԪ�ط��ţ���ͬ��
(2)�������γ��������������Ԫ����_______________���ֱ�д����Ԫ�ص�����������ޡ�������������Ӧˮ���ﷴӦ�Ļ�ѧ����ʽ��___________��___________��
(3)������������Ӧˮ����ĵ���ʽ______________��
(4)������ͼװ������֤ͬ����Ԫ�طǽ����Եı仯���ɣ�
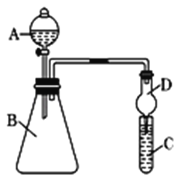
Ҫ֤���ǽ����ԣ�C��Si����A�м����ᣬB�м�CaCO3��C�м�Na2SiO3��Һ��Ӧ��B��D֮������һ��ʢ������____��ѡ��������ĸ��A Ũ���� ��B ŨNaOH��Һ��C ����Na2CO3��Һ ��D ����NaHCO3��Һ����ϴ��װ�ã��Ľ���C�з�����Ӧ�Ļ�ѧ����ʽ��_____��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ǻ����ɻ�����OH�������ԣ�O Ϊ-1 �ۣ���һ�ֻ��Ժ������������£����á�OH ���������ӷ�ˮ���ɽ���ת��Ϊ���������
��1����OH �ĵ���ʽΪ________��
��2�� pH=3 ʱ Fe2+�� H2O2 �ķֽ�����в�����OH �м��壬��ѭ����Ӧ���¡�������ʽ ii ����������
i��Fe2++ H2O2+H+ = Fe3++ H2O +��OH
ii��___ + ___= ___+ O2��+2H+
��3����֪���ǻ����ɻ���������� 2��OH = H2O2���Ӷ����Խ��ͣ��� H2O2 �ֽ�����ġ�OH �ѳ����ӣ���������������ʱ����ͬ�¶��£����ӵ�Ũ����ʱ��ı仯��ͼ 1 ��ʾ��0��20 min ʱ���¶ȴ�40�������� 50�棬��Ӧ���ʻ�������Ŀ���ԭ����________��
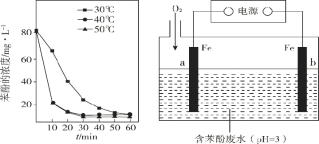
��4�����õ绯ѧ���������������ڵ����г���������OH��ʹ���������ӷ�ˮ���Ӹ�Ч��װ����ͼ2��ʾ����֪ a ����Ҫ�����ķ�Ӧ�� O2 ���� H2O2��Ȼ���ڵ��Һ�в�����OH ��Ѹ���뱽�ӷ�Ӧ��
��b �����ӵ�Դ��________�����������������
��a ���ĵ缫��ӦʽΪ______��
�۳��缫��Ӧ�⣬���Һ����Ҫ�����ķ�Ӧ����ʽ�� ________ �� _______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ҩ���м���(G)���л���ҩ��ҵ�е�һ�ֺϳɷ�������:
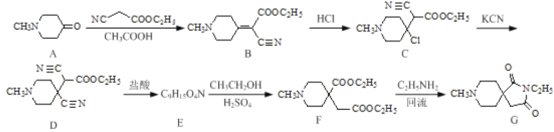
�ش���������:
(1)������D��G�к��������ŵ����Ʒֱ�Ϊ___________��_________��
(2)��B��C�ķ�Ӧ����Ϊ_____ ;д��C�� D��Ӧ�Ļ�ѧ����ʽ:________��
(3)������E�Ľṹ��ʽΪ________��
(4)��ӦF��G����һ����������___________��
(5)д��ͬʱ��������������B��ͬ���칹��Ľṹ��ʽ:_______��
����������Cu(OH)2���������·�Ӧ����ש��ɫ������ˮ�����֮һ����FeCl3��Һ������ɫ��Ӧ:
���˴Ź�������Ϊ�����,�������Ϊ1:2:4:9;
������������
(6)��֪:RCN![]() RCH2NH2�������HOOCCH2COOH��CH3CH2ClΪԭ���Ʊ�
RCH2NH2�������HOOCCH2COOH��CH3CH2ClΪԭ���Ʊ�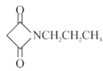 �ĺϳ�·��:_________(���Լ�����)��
�ĺϳ�·��:_________(���Լ�����)��
�鿴�𰸺ͽ���>>
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com