
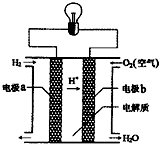
| A. | a电极是负极 | |
| B. | 该电池的总反应:2H2+O2═2H2O | |
| C. | 产物为无污染的水,属于环境友好电池 | |
| D. | 外电路中电子b电极通过导线流向a电极 |
分析 氢氧燃料电池中,氢气易失电子发生氧化反应,所以通入氢气的电极是负极,氧气易得电子发生还原反应,所以通入氧气的电极是正极;燃料电池总反应是燃料燃烧的化学方程式,电子是从负极流向正极,根据产物和能量的转化来回答.
解答 解:A、原电池中,电解质里的阳离子移向正极,所以电极b是正极,a是负极,故A正确;
B、燃料电池总反应是燃料燃烧的化学方程式:2H2+O2=2H2O,故B正确;
C、氢氧燃料电池的产物是水,环保无污染,是一种具有应用前景的绿色电源,属于环境友好电池,故C正确;
D、外电路中电子是从负极流向正极,由电极a通过导线流向电极b,故D错误;
故选D.
点评 本题考查了燃料电池,要注意的是:虽然燃料相同,但电解质溶液不同时,电极反应式就不同,如氢氧燃料电池,在酸性介质和碱性介质中的电极反应式就不同.


科目:高中化学 来源: 题型:选择题
| A | C | |
| B | D |
| A. | 气态氢化物的稳定性:HC>HD | |
| B. | 最高价氧化物对应水化物的酸性:H2BO4>HDO4 | |
| C. | 单质沸点最高的是B元素形成的单质 | |
| D. | A简单气态氢化物水溶液显碱性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 向两份蛋白质溶液中分别滴加饱和NaCl溶液和CuSO4溶液 | 均有固体析出 | 蛋白质均变性了 |
| B | 将淀粉溶液和稀H2SO4混合加热后,再滴加新制的Cu(OH)2悬浊液,煮沸 | 无砖红色沉淀产生 | 淀粉未水解 |
| C | 向苯酚浓溶液中滴加少量溴水,振荡 | 无白色沉淀 | 苯酚与溴水不反应 |
| D | CH3COOH、C2H5OH和浓H2SO4共热制备CH3COOC2H5,将共热后产生的气体导入盛有饱和Na2CO3溶液的试管中 | 有油状物浮于Na2CO3溶液表面,振荡后,油状层变薄 | 证明油状物不全部是CH3COOC2H5 |
| A. | A | B. | B | C. | C | D. | D |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | Cl-Cl | Br-Br | I-I | H-Cl | H-Br | H-I | H-H |
| 键能(kJ/mol) | 243 | 193 | 151 | 432 | 366 | 298 | 436 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 保存氢氧化钠溶液、硅酸钠溶液等碱性试剂,常用带橡胶塞的玻璃瓶 | |
| B. | 保存浓硝酸及硝酸银溶液,常用带玻璃塞的棕色试剂瓶 | |
| C. | 保存金属钠和液溴时,常在试剂瓶中加入煤油进行封存 | |
| D. | 保存氢氟酸时,常用塑料瓶而不用玻璃瓶 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
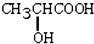 .问:
.问: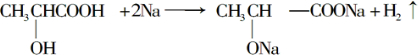
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com