
| A. | 1 mol•L-1的NaClO 溶液中含有ClO-的数目小于NA | |
| B. | 标准状况下,22.4LCCl4中含有个NACCl4分子 | |
| C. | 常温常压下,14 g 由N2与CO组成的混合气体含有的原子数目为NA | |
| D. | 足量的H2O2溶液与1molFe2+反应,转移2NA个电子 |
分析 A、溶于体积不明确;
B、标况下,四氯化碳为液态;
C、氮气和CO的摩尔质量均为28g/mol;
D、Fe2+与双氧水反应后变为+3价.
解答 解:A、溶于体积不明确,故溶于中的次氯酸跟的个数无法计算,故A错误;
B、标况下,四氯化碳为液态,故不能根据气体摩尔体积来计算其物质的量和分子个数,故B错误;
C、氮气和CO的摩尔质量均为28g/mol,故14g混合物的物质的量为0.5mol,而氮气和CO均为双原子分子,故0.5mol混合物中含1mol原子即NA个,故C正确;
D、Fe2+与双氧水反应后变为+3价,故1molFe2+转移1mol电子即NA个,故D错误.
故选C.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 过量CO2通入偏铝酸钠溶液中:2AlO2-+CO2+3H2O═2Al(OH)3↓+CO32- | |
| B. | 向次氯酸钠溶液中通入足量SO2气体:ClO-+SO2+H2O═HClO+HSO${\;}_{3}^{-}$ | |
| C. | 酸性条件下双氧水和KI溶液反应:2I-+H2O2+2H+═I2+2H2O | |
| D. | 碳酸氢铵溶液与足量的KOH溶液混合后加热:NH4++OH-$\frac{\underline{\;\;△\;\;}}{\;}$NH3↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
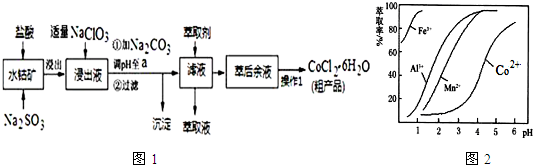
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若甲为AlCl3,则丁可能是NaOH | B. | 若甲为乙醇,则丙可能是乙酸 | ||
| C. | 若甲为Fe,则丁可能是稀硝酸 | D. | 若甲为NaOH 溶液,则丁可能是CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 现有下列化学试剂:
现有下列化学试剂:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 .
. +O2$→_{△}^{Cu}$
+O2$→_{△}^{Cu}$ +2H2O.
+2H2O. +2nNaOH$\stackrel{△}{→}$n
+2nNaOH$\stackrel{△}{→}$n +n
+n .
. (或
(或 、
、 )(只写出一种即可).
)(只写出一种即可).查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com