
| A. | ag某气体的分子数为b,则cg该气体在标况下的体积为$\frac{22.4bc}{a{N}_{A}}$L | |
| B. | 2L0.5mol.L-1磷酸溶液中含有H+的数目为3NA | |
| C. | 25℃,PH=13的Ba(OH)2溶液中含有OH-为0.1NA | |
| D. | 标准状况下,28g乙烯和丙烯的混合气体中,含有碳碳双键的数目为NA |
分析 A、ag某气体的分子数为b,则cg气体中分子个数为$\frac{bc}{a}$,其体积V=$\frac{N}{{N}_{A}}Vm$;
B、磷酸为弱酸;
C、溶液体积不明确;
D、乙烯和丙烯的摩尔质量不同.
解答 解:A、ag某气体的分子数为b,则cg气体中分子个数为$\frac{bc}{a}$,其体积V=$\frac{N}{{N}_{A}}Vm$=$\frac{22.4bc}{a{N}_{A}}L$,故A正确;
B、磷酸为弱酸,故不能完全电离,故溶液中的氢离子的个数小于3NA个,故B错误;
C、溶液体积不明确,故溶液中的氢氧根的个数无法计算,故C错误;
D、乙烯和丙烯的摩尔质量不相同,故28g混合物中乙烯和丙烯的物质的量之和不为定值,故含有的碳碳双键个数不确定,故D错误.
故选A.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:选择题
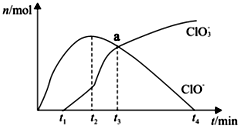 工业上将Cl 2通入冷的NaOH溶液中制得漂白液 (主要成分是NaClO ),室温下将Cl 2缓缓通入NaOH溶液中,得到ClO -、ClO 3-的物质的量与反应时间的关系如图所示,下列有关说法正确的是( )
工业上将Cl 2通入冷的NaOH溶液中制得漂白液 (主要成分是NaClO ),室温下将Cl 2缓缓通入NaOH溶液中,得到ClO -、ClO 3-的物质的量与反应时间的关系如图所示,下列有关说法正确的是( )| A. | HClO具有强氧化性,而NaClO没有氧化性 | |
| B. | 向漂白液中加入足量浓盐酸可增强漂白效果 | |
| C. | 无法求出a点时的溶液中,c( Na+ )和 c(Cl-)的比值 | |
| D. | t 2到t 4,n( ClO - )下降的原因可能是:3ClO -═2Cl-+ClO 3 - |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 按系统命名法,化合物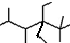 (键线式结构)的名称是2,3,5,5-四甲基-4,4-二乙基己烷 (键线式结构)的名称是2,3,5,5-四甲基-4,4-二乙基己烷 | |
| B. | 环己烯与化合物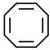 (键线式结构)互为同系物 (键线式结构)互为同系物 | |
| C. | 分子式为C4H8O2的有机物在酸性条件下可水解为酸和醇,若将所有可能得到的醇和酸重新酯化,可形成的酯共有16种 | |
| D. | 等物质的量的苯和苯甲酸完全燃烧消耗氧气的量相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 阳离子 | K+ Ag+ Mg2+ Ba2+ |
| 阴离子 | NO3- CO32- SiO32- SO42- |
| 序号 | 实验内容 | 实验结果 |
| Ⅰ | 向该溶液中加入足量稀盐酸 | 产生白色沉淀并放出标准状况下0.56L气体 |
| Ⅱ | 将Ⅰ的反应混合液过滤,对沉淀洗涤、灼烧至恒重,称量所得固体质量 | 固体质量为2.4g |
| Ⅲ | 向Ⅱ的滤液中滴加BaCl2溶液 | 无明显现象 |
| 阴离子 | NO3- | CO32- | SiO32- | SO42- |
| c(mol•h-1) |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 试管、蒸发皿既能用于给固体加热也能用于给溶液加热 | |
| B. | 分液漏斗既能用于某些混合物的分离也能用于组装气体发生装置 | |
| C. | 碱式滴定管既可用于中和滴定,也可用于量取一定量的NaCl或AlCl3溶液 | |
| D. | 测量酒精沸点的实验中,应使温度计水银球位于被加热的酒精中 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题:
300℃下,将2mol SO21mol O2混合于2L的恒容密闭容器中,发生反应:2SO2(g)+O2(g)?2SO3(g)△H,2分钟末达到平衡,测得SO2的转化率为60%,请根据化学反应的有关原理回答下列问题:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com