
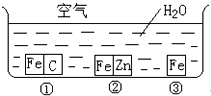
 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:| 4.00g×70%×22.4L |
| 56g |


科目:高中化学 来源: 题型:
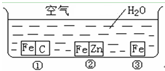 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如下图所示,铁处于①、②、③三种不同的环境中.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
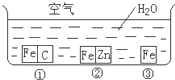 如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:
如何防止铁的锈蚀是工业上研究的重点内容.为研究铁的锈蚀,某同学做了探究实验,如图所示,铁处于①、②、③三种不同的环境中.请回答:查看答案和解析>>
科目:高中化学 来源: 题型:
序号 |
内容 | 实验现象 |
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在高于常温的空气中一小时 | 铁丝表面已变得灰暗 |
| 5 | 将浸过氯化钠溶液的铁丝放在高于常温的空气中一小时 | 铁丝表面灰暗程度比实验4严重 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 序号 | 内容 | 实验现象 |
| 1 | 常温下将铁丝放在干燥空气中一个月 | 干燥的铁丝表面依然光亮 |
| 2 | 常温下将铁丝放在潮湿空气中一小时 | 铁丝表面依然光亮 |
| 3 | 常温下将铁丝放在潮湿的空气中一个月 | 铁丝表面已变得灰暗 |
| 4 | 将潮湿的铁丝放在常温的氧气流中一小时 | 铁丝表面略显灰暗 |
| 5 | 将潮湿的铁丝放在高于常温的氧气流中一小时 | 铁丝表面已变得灰暗 |
| 6 | 将浸过氯化钠溶液的铁丝放在高于常温的氧气流中一小时 | 铁丝表面灰暗程度比实验5严重 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com