
| A. | K+、Br-、CO${\;}_{3}^{2-}$ | B. | Ba2+、Al3+、Cl- | ||
| C. | NH${\;}_{4}^{+}$、Fe3+、SO${\;}_{4}^{2-}$ | D. | Ag+、H+、NO${\;}_{3}^{-}$ |
分析 A.三种离子之间不反应,通入氨气后也不反应;
B.铝离子与氨气在溶液中反应生成氢氧化铝沉淀;
C.铁离子与氨气在溶液中反应生成氢氧化铁沉淀;
D.银离子、氢离子与通入的氨气发生反应.
解答 解:A.K+、Br-、CO32-之间不反应,通入氨气后也不反应,在溶液中能够大量共存,故A正确;
B.通入氨气后,Al3+与氨气反应生成氢氧化铝沉淀,通入氨气后不能大量共存,故B错误;
C.通入氨气后,Fe3+与氨气反应生成氢氧化铝沉淀,通入氨气后不能大量共存,故C错误;
D.Ag+、H+与通入的氨气反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如“往某溶液中通入足量NH3后,溶液中还可能大量存在”,试题培养了学生的分析能力及灵活应用能力.


科目:高中化学 来源: 题型:多选题
| A. | 气体的颜色不再发生变化 | |
| B. | 容器内的压强不再发生变化 | |
| C. | 单位时间内,每断裂2mol H-I键,同时有1mol I-I键生成 | |
| D. | 单位时间内,每断裂1mol H-H键,同时有1mol I-I键生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
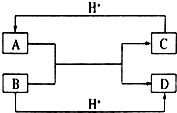 已知A、B、C、D是中学化学中常见的四种不同粒子,均是10电子的粒子,在通常情况下,C是气体,具有刺激性气味;D为液体.它们之间存在如图所示的转化关系(反应条件已经略去):
已知A、B、C、D是中学化学中常见的四种不同粒子,均是10电子的粒子,在通常情况下,C是气体,具有刺激性气味;D为液体.它们之间存在如图所示的转化关系(反应条件已经略去):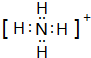 ;D
;D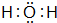 .写出B、C的离子符号或化学式:BOH-;CNH3.
.写出B、C的离子符号或化学式:BOH-;CNH3.查看答案和解析>>
科目:高中化学 来源: 题型:填空题
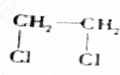 +2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;
+2NaOH$→_{△}^{H_{2}O}$HOCH2CH2OH+2NaCl;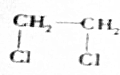 +2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;
+2NaOH$→_{△}^{乙醇}$CH≡CH↑+2NaCl+2H2O;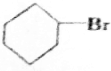 +NaOH$→_{△}^{H_{2}O}$
+NaOH$→_{△}^{H_{2}O}$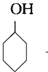 +NaBr;
+NaBr;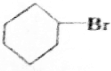 +NaOH$→_{△}^{C_{2}H_{5}OH}$
+NaOH$→_{△}^{C_{2}H_{5}OH}$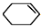 +H2O+NaBr.
+H2O+NaBr.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
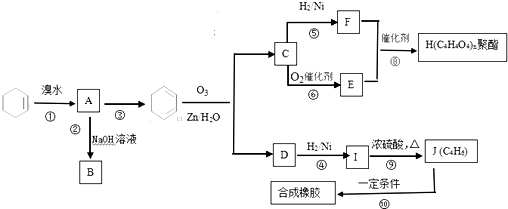
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
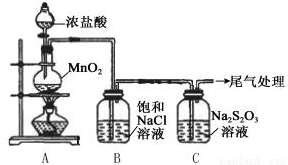
| 操作 | 现象 |
| 打开分液漏斗活塞,滴加一定量浓盐酸,加热 | i.A中有黄绿色气体生成,C中液面上方有白雾,溶液中开始出现少量浑浊; ii.一段时间后,C中产生大量黄色沉淀. |
| 用湿润的淀粉碘化钾试纸检验C中白雾 | 淀粉碘化钾试纸变蓝 |
| C中浊液过滤后,取少量滤液用盐酸酸化,滴加氯化钡溶液 | 有白色沉淀生成 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 丙酮与HCN发生加成反应 | |
| B. | 1,3-丁二烯生成 聚1,3-丁二烯 | |
| C. | 乙二醇与重铬酸钾溶液共热被氧化为乙二酸(HOOC-COOH) | |
| D. | 乙苯与酸性高锰酸钾溶液反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com