
| A、任何能使熵值增大的过程都能自发进行 |
| B、已知热化学方程式2SO2(g)+O2(g)?2SO3(g)△H=-Q kJ?mol-1(Q>0),则将2 mol SO2(g) 和1 mol O2(g)置于一密闭容器中充分反应后放出Q kJ的热量 |
| C、化学平衡发生移动,平衡常数一定发生变化 |
| D、足量的锌粒分别和等体积同浓度的 CH3COOH、HCl反应,两者放出氢气质量相同 |


 导学教程高中新课标系列答案
导学教程高中新课标系列答案 小学课时特训系列答案
小学课时特训系列答案科目:高中化学 来源: 题型:
| A、往FeI2溶液中通人过量氯气:Cl2+2Fe2+=2Cl-+2Fe3+ |
| B、向Na[Al(OH)4]溶液中通入少量C02:2[Al(OH)4]-+CO2=2Al(OH)3↓+C032-+H2O |
| C、向Na2S2O3溶液中通入足量氯气:S2O32-+2Cl2+3H2O=2SO32-+4Cl-+6H+ |
| D、在强碱溶液中次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3=FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、漂白粉溶液在空气中失效:ClO-+CO2+H2O=HClO+HCO3- | ||||
B、用浓盐酸与MnO2 反应制取少量氯气:MnO2+4H++2Cl-
| ||||
| C、向NaAlO2 溶液中通入过量的CO2 制取Al(OH)3:AlO2-+CO2+2H2O=Al(OH)3↓+HCO3- | ||||
| D、在强碱溶液中,次氯酸钠与Fe(OH)3反应生成Na2FeO4:3ClO-+2Fe(OH)3=2FeO42-+3Cl-+H2O+4H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、碱性锌锰电池是二次电池 |
| B、MnO2发生了还原反应 |
| C、反应消耗 0.65gZn,有0.01 mol电子发生转移 |
| D、电池正极的反应为:Zn+2 OH--2e-=Zn(OH)2 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、制取蒸馏水时,为防止烧瓶内产生暴沸现象,应先向烧瓶中加入几片碎瓷片 |
| B、在用系列实验装置制取和检验的实验中,尾气污染空气,一定要用水吸收尾气 |
| C、用加热KMnO4的方法制得的氧气中常带有紫色,应在靠近试管口处放一团棉花 |
| D、在点燃甲烷气体前,为防止爆炸,应先验纯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、明矾常作为消毒剂 |
| B、发酵粉中主要含有碳酸氢钠,能使焙制出的糕点疏松多孔;而碳酸钠可作医疗上治疗胃酸过多的一种药剂 |
| C、高纯度的硅单质广泛用于制作光导纤维 |
| D、氧化铝可用来制造耐火砖和坩埚等 |
查看答案和解析>>
科目:高中化学 来源: 题型:
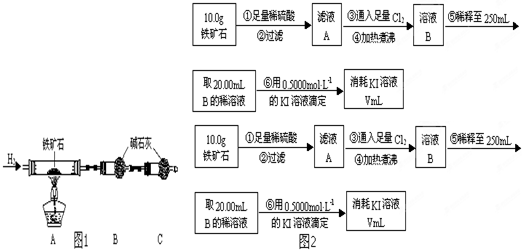
查看答案和解析>>
科目:高中化学 来源: 题型:
| 放电 |
| 充电 |
查看答案和解析>>
科目:高中化学 来源: 题型:
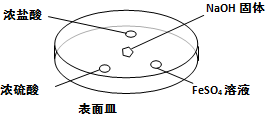
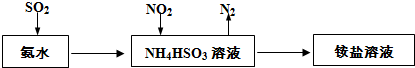
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com