
铁是应用最广泛的金属,铁的卤化物、氧化物以及高价铁的含氧酸盐均为重要化合物。
(1)要确定铁的某氯化物FeClx的化学式,可用离子交换和滴定的方法。实验中称取0.54 g的FeClx样品,溶解后先进行阳离子交换预处理,再通过含有饱和OH-的阴离子交换柱,使Cl-和OH-发生交换。交换完成后,流出溶液的OH-用0.40 mol·L-1的盐酸滴定,滴至终点时消耗盐酸25.0 mL。计算该样品中氯的物质的量,并求出FeClx中x的 值:__________________(列出计算过程)。
值:__________________(列出计算过程)。
(2)现有一含有FeCl2和FeCl3的混合物样品,采用上述方法测得n(Fe)∶n(Cl)=1∶2.1,则该样品中FeCl3的物质的量分数为__________。在实验室中,FeCl2可用铁粉和__________反应制备,FeCl3可用铁粉和__________反应制备。
科目:高中化学 来源: 题型:
常温下,某无色透明的溶液中,下列各组离子能够大量共存的是
A.H+、Na+、Cl-、CO32- B. Ba2+、Na+、SO42-、Cl-
C.MnO4-、K+、I-、H+ D. Mg2+、Cl-、NO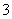 、H+
、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
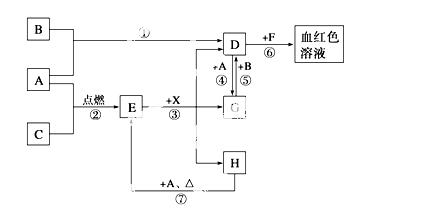
A、B、C为中学常见单质,其中一种为金属,通常情况下,A为固体,B为黄绿色气体,C为无色气体。D、E、F、G、H、X均为化合物,其中X常温下是无色气体,其水溶液是一种强酸,E为黑色固体,H在常温下为液体。它们之间的转化关系如下图所示(其中某些反应条件和部分反应物已略去)。
请回答下列问题:
(1)写出下列物质的化学式:A__________、D__________、E__________、X_________。
(2)在反应①~⑦中,不属于氧化还原反应的是__________(填编号)。
(3)反应④的离子方程式是_____________________________________________;
(4)反应⑦的化学方程式是_____________________________________________;
该反应中每消耗0.3 mol的A,可转移电子______mol。
(5)写出D的溶液与小苏打溶液反应的离子方程式是________________________
 _____________________________________________________________________。
_____________________________________________________________________。
(6)除去D溶液中混有的少量G的方法是_________________________________
_____________________________________________________________________。
(7)在D溶液中制备无水D固体的方法是__________________________________
_____________________________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
有NaCl、FeCl2、FeCl3、MgCl2、AlCl3五种溶液,用一种试剂就可把它们鉴别开来,这种试剂是( )
A.盐酸 B.烧碱溶液 C.氨水 D.KSCN溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
下列反应中,反应后固体物质增重的是
A.氢气通过灼热的CuO粉末 B.二氧化碳通过Na2O2粉 末
末
C.铝与Fe2O3发生铝热反应 D.将锌粒投入Cu(NO3)2溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
科学家提出硅是“21世纪的能源”,这主要是由于作为半导体材料的硅在太阳能发电过程中具有重要的作用。下列关于硅的说法中正确的是 ( )
A.自然界硅的贮量丰富 B.自然界中存在大量单质硅
C.二氧化硅被用于制作计算机芯片 D.光导纤维的主要成分是Si
查看答案和解析>>
科目:高中化学 来源: 题型:
硅单质及其化合物应用范围很广.
(1)制备硅半导体材料必须先得到高纯硅,工业上可以按如下步骤制备纯硅.
Ⅰ.高温下用碳还原二氧化硅制得粗硅
Ⅱ.粗硅与干燥的氯气在450℃~500℃条件下反应制得SiCl4
Ⅲ.SiCl4液体经精馏提纯后与过量H2在1100℃~1200℃条件下反应制得纯硅
已知SiCl4沸点为57.6℃,能与H2O强烈反应.1 mol H2与SiCl4气体完全反应吸收的热量为120.2 kJ.
请回答下列问题:
①第Ⅲ步反应的热化学方程式是__________________ ____________________
____________________
_______________________________________________________________________。
②整个制备纯硅的过程中必须严格控制无水无氧.SiCl4在潮湿的空气中因水解而产生白色烟雾,其生成物是____________;H2还原SiCl4过程中若混入O2,可能引起的后果是____________.
③上述生产过程所需氯气和氢气均由氯碱厂提供,氯碱厂的基本设备是离子交换膜电解槽(如图所示),其中进入阳极室的溶液是__________________________________,b电极上的电极
反应式是______________________________________________________.

(2)二氧化硅被大量用于生产玻璃.工业上用SiO2、Na2CO3和CaCO3共283 kg在高温下完全反应时放出CO2 44 kg,生产出的玻璃可用化学式Na2SiO3·CaSiO3·xSiO2表示,则其中x=_____ ___。
___。
查看答案和解析>>
科目:高中化学 来源: 题型:
在某温度时,测得纯水中的[H+]=2.0×10-7 mol·L-1,则[OH-]为( )
A.2.0×10-7 mol·L-1
B.0.1×10-7 mol·L-1
C.1.0×10-14/2.0×10-7 mol·L-1
D.无法确定
查看答案和解析>>
科目:高中化学 来源: 题型:
下列对沉淀溶解平衡的描述正确的是( )
A.反应开始时,溶液中各离子浓度相等
B.沉淀溶解达到平衡时,沉淀的速率和溶解的速率相等
C.沉淀溶解达到平衡时,溶液中溶质的离子浓度相等,且保持不变
D.沉淀溶解达到平衡时,如果再加入难溶性的该沉淀物,将促进溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com