
| A. | 用10mL量筒量取7.13mL稀盐酸 | |
| B. | 用pH计测得某稀盐酸的pH为1.54 | |
| C. | 广泛pH试纸润湿后,测得某溶液的pH为2.3 | |
| D. | 用标准的盐酸滴定待测的NaOH溶液时,滴定完毕后,酸式滴定管中盐酸的读数为17.1mL |
科目:高中化学 来源: 题型:选择题
| A. | Fe(OH)3胶体粒子直径在1nm~100 nm之间 | |
| B. | 胶体区别于其他分散系的本质特征是有丁达尔效应 | |
| C. | Fe(OH)3胶体中混有少量FeCl3,可以采取过滤的方法分离 | |
| D. | 将饱和FeCl3溶液滴加到沸水中长时间加热制得Fe(OH)3胶体 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 浓硫酸有氧化性,稀硫酸没有氧化性 | |
| B. | 稀释浓硫酸时,将浓硫酸沿着量筒壁慢慢注入盛水的量筒中,并不断搅拌 | |
| C. | 硝酸浓度越大氧化能力越强 | |
| D. | 金属和硝酸反应,浓度由浓到稀,对应的还原产物有NO2、NO和H2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | Na+的结构示意图为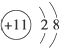 | |
| B. | 明矾的化学式为KAl(SO4)2•12H2O | |
| C. | 某微粒的电子数等于质子数,则该微粒可能是分子或离子 | |
| D. | 化学变化不产生新元素,产生新元素的变化不是化学变化 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 钛(Ti)被称为继铁、铝之后的第三金属.
钛(Ti)被称为继铁、铝之后的第三金属.查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
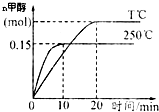 将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根据图示判断,下列结论正确的是( )
将1molCO和2molH2充入一容积为1L的密闭容器中,分别在250℃、T℃发生反应:CO(g)+2H2(g)?CH3OH(g)△H=akJ/mol,根据图示判断,下列结论正确的是( )| A. | a<0,T<250 | |
| B. | 250℃时,0~10min内:v(H2)=0.015mol/(L•min) | |
| C. | CO的平衡转化率在250℃时比T℃大 | |
| D. | 250℃时,起始时向容器中改充1molCH3OH气体,恒温达平衡后,CH3OH的物质的量大于0.15mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com