
| A. | ①②③ | B. | ③④⑤ | C. | ②③⑤ | D. | ①③⑤ |
分析 ①钠的密度小于水,且可以和水反应;
②钠的密度小于四氯化碳;
③钠的化学性质活泼,可以和空气成分反应;
④钠和硫酸铜溶液的反应先是和水之间的反应;
⑤钠原子在反应中只能失电子,只有还原性.
解答 解:①钠的密度小于水,且可以和水反应产生氢气,钠与水反应时浮于水面且呈小球状游动,故正确;
②钠的密度小于四氯化碳,不可以保存在四氯化碳中,故错误;
③钠的化学性质活泼,可以和空气成分反应,在自然界中只能以化合态形式存在,故正确;
④钠和硫酸铜溶液的反应先是和水之间的反应,不可从硫酸铜溶液中置换出铜,故错误;
⑤钠原子在反应中只能失电子,只有还原性而没有氧化性,故正确.
故选D.
点评 本题考查学生金属钠的性质以及存在,注意知识的归纳和梳理是关键,难度不大.


科目:高中化学 来源: 题型:选择题
| A. | 用渗析的方法除去NaCl溶液中含有的少量淀粉胶体 | |
| B. | 用加热、蒸发的方法可以除去粗盐中的CaCl2、MgCl2杂质 | |
| C. | 分液时,分液漏斗中下层液体从下口放出,上层液体从上口倒出 | |
| D. | 用丁达尔效应鉴别Fe(OH)3胶体和FeCl3溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 的表述不正确的是( )
的表述不正确的是( )| A. | 该物质能发生加成、取代、氧化反应 | |
| B. | 该物质遇FeC13溶液显色,lmol该物质遇浓溴水时最多与1mo1Br2发生取代反应 | |
| C. | 该物质的分子式为C11H14O3 | |
| D. | 1mol该物质最多消耗Na,NaOH,NaHC03的物质的量之比为2:2:1 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
| 实验编号 | HA物质的量 浓度(mol/L) | NaOH物质的 量浓度(mol/L) | 混合溶液的pH |
| 甲 | 0.2 | 0.2 | pH=a |
| 乙 | c1 | 0.2 | pH=7 |
| 丙 | 0.2 | 0.1 | pH>7 |
| 丁 | 0.1 | 0.1 | pH=9 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:解答题
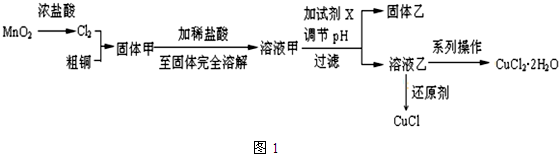
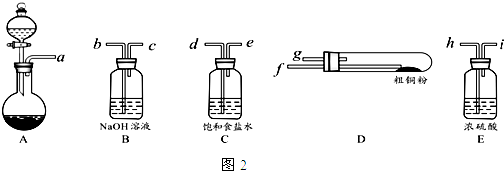
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).
用惰性电极电解200mL一定浓度的硫酸铜溶液,实验装置如图①所示,电解过程中的实验数据如图②所示,横坐标表示电解过程中转移电子的物质的量,纵坐标表示电解过程中产生气体的总体积(标准状况).查看答案和解析>>
科目:高中化学 来源: 题型:填空题
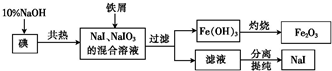
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com