
| A. | 恒压下充入稀有气体 | B. | 减小反应容器的体积 | ||
| C. | 升高反应温度 | D. | 分离出生成物 |
分析 根据平衡移动原理解答,改变影响平衡的一个条件(如浓度、压强或温度等),平衡就向能够减弱这种改变的方向移动.
解答 解:A.恒压下充入稀有气体,反应体系分压减小,平衡向气体体积增大的方向移动,但不能确定正反应为气体体积增大的反应,故A错误;
B.减小反应容器的体积,压强增大,平衡向气体体积减小的方向移动,但不能确定正反应为气体体积减小的反应,故B错误;
C.升高温度平衡向吸热反应方向移动,但正反应不一定是吸热反应,故C错误;
D.分离出生成物,生成物的浓度减小,平衡向正反应方向移动,故D正确,
故选:D.
点评 本题考查化学平衡移动的影响因素,比较基础,注意反应特征不确定,注意对化学平衡移动原理的理解,移动结果是减弱改变趋势,不是消除改变.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
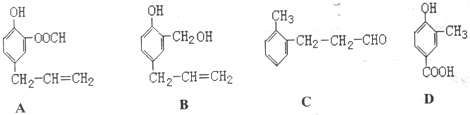
 .
. ;H:
;H: .
.查看答案和解析>>
科目:高中化学 来源: 题型:选择题
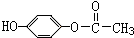
| A. | NH5中既有共价键又有离子键 | |
| B. | NH5的电子式为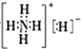 | |
| C. | 1 mol NH5中含有5NA个N-H键(NA表示阿伏加德罗常数) | |
| D. | 它与水反应的离子方程式为NH4++H-+H2O═NH3•H2O+H2↑ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )
现有短周期主族元素X、Y、Z、R、T.R原子最外层电子数是电子层数的2倍,Y与Z能形成Z2Y、Z2Y2型离子化合物,Z与T形成化学式为Z2T的离子化合物.五种元素的原子半径与原子序数的关系如图所示.下列推断正确的是( )| A. | 原子半径和离子半径均满足:Y<Z | |
| B. | 最高价氧化物对应的水化物的酸性:T<R | |
| C. | 气态氢化物的稳定性:Y>T | |
| D. | 由X、Y、Z、T四种元素组成的化合物水溶液一定呈中性 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 原溶液中不含HCO3-和CO32- | |
| B. | 向加盐酸后的溶液中再加KSCN溶液,显红色 | |
| C. | 能确定原溶液中的五种离子 | |
| D. | 原溶液中有三种阳离子和两种阴离子 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 蛋白质是两性物质 | |
| B. | 蛋白质分子中的重要化学键是肽键(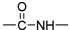 ) ) | |
| C. | 天然蛋白质水解的最终产物是α-氨基酸 | |
| D. | 蛋白质溶液中分别加入浓NaCl溶液、CuSO4溶液,其过程都是不可逆的 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com