
【题目】生铁的熔点是1100℃~1200℃,则纯铁的熔点可能是( )
A.1055℃
B.1100℃
C.1200℃
D.1535℃
科目:高中化学 来源: 题型:
【题目】向5OmL1mol/L的Al2(SO4)3溶液中加入一定量的金属钠,充分反应后,对该溶液的分析合理的是
①可能析出另一种有金属光泽的固体 ②可能无沉淀析出
③可能有7.8g沉淀析出 ④可能析出3.9沉淀
A. ②③④ B. ③④ C. ①③ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室采用不同的实验装置研究苯与液溴的反应类型并制取少量溴苯。
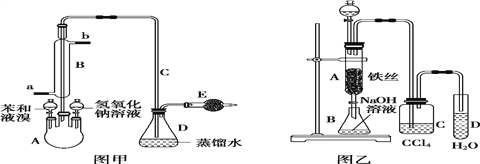
Ⅰ.若用图甲装置进行制备实验,回答下列问题:
(1)A 中预先需加入的试剂是___________,E 中需加入的试剂是____________。
(2)仪器 B 的作用是_________,__________________。
Ⅱ.若用图乙装置进行制备实验,回答下列问题:
(1)C 中盛放 CCl4 的作用_________;
(2)实验结束时,打开 A 下端的活塞,让反应液流入 B 中,充分振荡,写出有关的离子方程式:
________________________,然后用__________________(填仪器名称)分离出溴苯(仍含有少量苯);
(3)反应完毕后,向试管 D 中滴加 AgNO3 溶液,________________(填现象),此现象说明由苯与液溴获得溴苯的反应属于___________________________(填有机反应类型)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】空间实验室“天宫一号”的供电系统中有再生氢氧燃料电池(RFC),RFC是一种将水电解技术与氢氧燃料电池技术相结合的可充电电池。下图为RFC工作原理示意图,有关说法正确的是
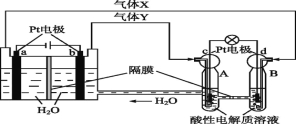
A.当有0.1 mol电子转移时,a极产生1.12 L O2(标准状况下)
B.b极上发生的电极反应是:4H2O+4e- =2H2↑+4OH-
C.c极上进行还原反应,B中的H+可以通过隔膜进入A
D.d极上发生的电极反应是:O2+4H++4e- =2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物A是合成天然橡胶的单体,分子式为C5H8。A的一系列反应如图(部分反应条件略去)
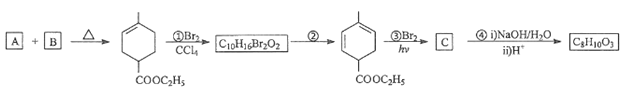
已知:(1)![]()
(2)CH3COOCH2CH3+H2O![]() CH3COOH+CH3CH2OH
CH3COOH+CH3CH2OH
回答下列问题:
(1)A的结构简式为_______。
(2)B的分子式为_______。
(3)②的反应方程式为_______。
(4)①和③的反应类型分别是_____, ______。
(5)C为单溴代物,分子中有两个亚甲基,其结构简式为__________。
(6)分子中含有两个碳碳双键,且两个双键之间有一个碳碳单键的共轭二烯烃与单烯径都可发生类似A和B之间的反应。请写出均为六元环烃的M(C6H10)与N(C6H8)发生该类反应的化学方程式____________________。
(7)A的同分异构体中不含累积二烯(C=C=C)结构单元的链状经还有_______种(不考虑顺反异构)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学与生活密切相关。下列说法不正确的是
A.过氧化钠可用作潜水艇中的供氧剂 B.氧化铝可用于制造耐火坩埚
C.明矾可用作自来水消毒剂 D.铁粉作食品袋内的脱氧剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】从镍矿石尾矿中提取NiSO4是解决我国镍资源匮乏的一条重要途径,已知该过程如下:
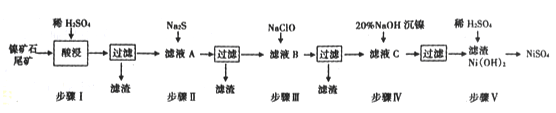
表1:各物质的Ksp数据如下表:
物质 | MnS | NiS | PbS | CuS | Ni(OH)2 |
Ksp | 2.5×10-13 | 1.1×10-21 | 8.0×10-28 | 6.3×10-36 | 2.0×10-15 |
表2:滤液A中各金属离子的含量如下表:
成分 | Ni2+ | Fe3+ | Fe2+ | Mn2+ | Cu2+ | Pb2+ | …… |
3.80 | 4.80 | x | 0. 20 | 0.15 | <0.001 | …… |
根据以上信息,回答下列问题:
(1)步骤I酸浸之前需将矿石粉碎,目的是____________。
(2)若杂质离子的浓度c≤1.0×10-5mol/L即可认定沉淀完全,则步骤Ⅱ中当Pb2+“恰好沉淀完全时,溶液中硫离子的浓度c(S2-)=_____________
(3)常温下进行步骤Ⅲ的目的是为了除去铁和锰元素,已知除铁元素的离子反应如下:
2Fe2++ ClO - +5H2O=2Fe( OH)3↓+Cl-+4H+
此时Mn2+的氧化产物为MnO2,写出除锰元素的离子方程式______________。
(4)为测定滤液A中Fe2+离子的含量,(每升溶液中含有的亚铁离子的质量,以g/L表示)每次移取20.00 mL待测液,并用0.02 mol/L的KMnO4溶液滴定,若已知其他离子均不反应,且三次滴定平均消耗KMnO4溶液18. 00mL,则x的值为________(精确到小数点后两位)。
(5)所得Ni(OH)2是制造镍镉电池的重要原料,镍镉电池工作原理如下:
Cd+2NiO(OH) +2H2O![]() Cd(OH)2+2Ni(OH)2
Cd(OH)2+2Ni(OH)2
则随着放电的进行,正极区pH______(填“增大”、“减小”或“不变”);充电时阴极电极反应式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚对苯二甲酸乙二酯(J)具有良好的力学性能,其薄膜的伸拉强度是聚乙烯薄膜的9倍。它的合成路线如下:
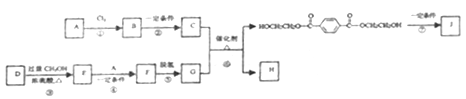
已知:
①![]()
②酯与醇可发生如下酯交换反应:RCOOR′+R〞OH ![]() RCOOR〞+R′OH(R、R′、R〞代表烃基)
RCOOR〞+R′OH(R、R′、R〞代表烃基)
(1)A的产量标志着一个国家石油化工发展水平,反应①的反应类型为______________。
(2)C的分子式是C2H6O2,是汽车防冻液的主要成分。反应②的试剂和反应条件是____________。
(3)D的分子式是C6H6O4,是一种直链结构的分子,核磁共振氢谱有3种峰,D种含有的官能团是______。
(4)F的结构简式是__________________。
(5)反应⑥的化学方程式是_________________。
(6)反应⑦为缩聚反应,反应⑦的化学方程式是_________________。
(7)G是一种同分异构体,G′为甲酸酯,核磁共振氢谱有3种峰且1mol该有机物酸性条件下水解产物能与2molNaOH反应。G′的结构简式为______________。
(8)以对二甲苯、甲醇为起始原料,选用必要的无机试剂合成G,写出合成路线(用结构简式表示有机物,用箭头表示转化关系,箭头上注明试剂和反应条件)___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com