
分析 (1)反应物KIO3中I元素化合价为+5价,KI中I元素化合价为-1价,反应中I元素化合价分别由+5价、-1价变化为0价,KIO3为氧化剂,KI为还原剂,结合氧化还原反应得失电子守恒配平方程式;
(2)依据方程式判断氧化剂、还原剂及物质的量之比;
(3)依据方程式各元素化合价变化计算转移0.5mol电子,则生成I2的物质的量;
(4)根据萃取剂的选择必须符合下列条件:溶质在萃取剂中的溶解度比在原溶剂中要大;萃取剂与原溶剂不相溶;萃取剂与溶质不反应;
(5)依据碘酸钾不稳定受热分解的性质解答.
解答 解:(1)反应物KIO3中I元素化合价为+5价,KI中I元素化合价为-1价,反应中I元素化合价分别由+5价、-1价变化为0价,可知(KIO3):n(KI)=1:5,结合质量生成配平方程式为KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,
故答案为:1;5;3;3;3;3;
(2)由(1)可知KIO3为氧化剂,KI为还原剂,(KIO3):n(KI)=1:5,故答案为:1:5;
(3)依据方程式:KIO3+5KI+3H2SO4═3K2SO4+3I2+3H2O,可知转移5mol电子生成3mol碘单质,则转移0.5mol电子,则生成I2的物质的量为0.3mol;
故答案为:0.3mol;
(4)①碘水中加入水,不会分层,仍然为碘水,故错误;
②酒精与水互溶,故错误;
③淀粉遇到碘变蓝,不能用淀粉溶液萃取碘,故错误;
④碘在苯中的溶解度大于在水中的溶解度,且碘与苯不反应,水与苯不互溶,故正确;
故选:④;
(5)碘酸钾不稳定受热分解,所以加碘食盐不能长时间炖炒,且应避热保存,故答案为:碘酸钾受热易分解.
点评 本题考查了氧化还原反应方程式的配平,氧化还原反应基本概念及电子转移数目的计算,碘的萃取,明确氧化还原反应规律,萃取剂的选择原则是解题关键,题目难度不大.


 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
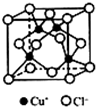 I.下表是A、B、C、D、E五种短周期元素的某些性质:
I.下表是A、B、C、D、E五种短周期元素的某些性质:| A | B | C | D | E | |
| 化合价 | -4 | -2 | -1 | -2 | -1 |
| 电负性 | 2.5 | 2.5 | 3.0 | 3.5 | 4.0 |
| X | Y | Z | |
| 第一电离能/(kJ/mol) | 520.2 | 495.8 | 418.8 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

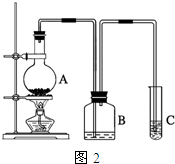
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 若T1=T2,则x1>x2 | B. | 若T1=T2,则x1<x2 | C. | 若T1<T2,则x1=x2 | D. | 若T1<T2,则x1<x2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 合成氨工业中,移走NH3可增大正反应速率,提高原料转化率 | |
| B. | 酸碱中和滴定时,锥形瓶需用待测液润洗2~3次,再加入待测液 | |
| C. | 将NO2、N2O4混合气体的体积压缩为原来的一半,则气体颜色加深 | |
| D. | 电解精炼铜过程中,阳极质量的减少与阴极质量的增加一定相等 |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
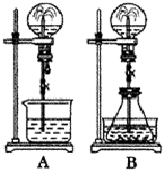 喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题:
喷泉实验是一种常见的自然现象,其产生原因是存在压强差.试根据下图,回答下列问题:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
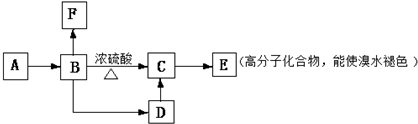
 ,
,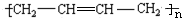 .
.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com