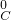【答案】
分析:最高价态的元素只有氧化性,能被还原成低价态,最低价态的元素只有还原性,能被氧化成高价态,中间价态的既有氧化性又有还原性,物质的性质决定用途.
解答:解:①硫化氢具有还原性,二氧化硫既有氧化性又有还原性,所以硫化氢和二氧化硫能发生氧化还原反应生成硫单质,反应方程式为:2H
2S+SO
2=3S+2H
2O,故答案为:2H
2S+SO
2=3S+2H
2O;
②硫单质是淡黄色固体,常温下,水是液体,所以反应现象是:有淡黄色固体生成,并有液滴生成,
故答案为:有淡黄色固体生成,并有液滴生成;
③氯气中氯元素是0价,属于中间价态,所以氯气既有氧化性又有还原性,氯气和水反应生成盐酸和次氯酸,反应方程式为:Cl
2+H
2O=HCl+HClO,
故答案为:Cl
2+H
2O=HCl+HClO;
④该反应Cl
2+H
2O=HCl+HClO中,氯元素的化合价既有升高的又有降低的,所以氯气既是氧化剂又是还原剂,
故答案为:Cl
2、Cl
2;
⑤铁离子的价态是最高价,具有氧化性,铁原子的价态是最低价,具有还原性,铁离子和铁能发生氧化还原反应生成亚铁离子,反应方程式为:Fe+2FeCl
3=3FeCl
2,
故答案为:Fe+2FeCl
3=3FeCl
2;
⑥铁离子是棕黄色,亚铁离子是浅绿色,当氯化铁转化为氯化亚铁时,溶液的颜色由棕黄色变为浅绿色,
故答案为:棕黄色变为浅绿色;
⑦二氧化硅中硅元素是最高价态,具有氧化性,能被还原剂还原生成硅,如被碳还原,反应方程式为:
SiO
2+2C

Si+2CO,
故答案为:SiO
2+2C

Si+2CO;
⑧该反应SiO
2+2C

Si+2CO中有单质硅生成,硅能用于制造硅芯片,所以该反应的工业用途是:制备单质硅;
⑨二氧化碳中碳元素具有最高价,能作氧化剂,氧化具有还原性的物质,如:镁在二氧化碳中燃烧生成氧化镁和碳,反应方程式为:CO
2+2Mg
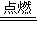
C+2MgO,
故答案为:CO
2+2Mg

C+2MgO;
⑩镁在二氧化碳中燃烧,生成黑色的固体碳和白色固体氧化镁,且产生耀眼的白光,
故答案为:产生耀眼的白光,有白色固体和黑色固体生成.
点评:本题考查了氧化还原反应和反应方程式的书写,明确元素化合价与元素性质之间的关系是解本题关键,注意碳和二氧化硅反应的生成物是一氧化碳而不是二氧化碳,为易错点.

 →
→ ←
←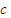
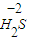 →
→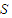 ←
←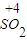
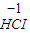 ←
←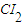 →
→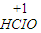
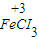 →
→ ←
←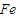
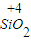 →
→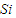
 Si+2CO,
Si+2CO, Si+2CO;
Si+2CO; Si+2CO中有单质硅生成,硅能用于制造硅芯片,所以该反应的工业用途是:制备单质硅;
Si+2CO中有单质硅生成,硅能用于制造硅芯片,所以该反应的工业用途是:制备单质硅; C+2MgO,
C+2MgO, C+2MgO;
C+2MgO;

 备战中考寒假系列答案
备战中考寒假系列答案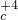 →
→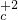 ←
←
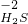 →
→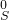 ←
←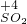
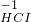 ←
←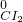 →
→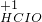
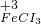 →
→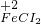 ←
←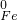
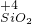 →
→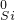
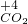 →
→