
分析 (1)氮元素与硫元素可形成一种化合物X.设X为NxSy,依据摩尔质量列式计算讨论得到化学式;
(2)设S2Cl2、SCl2的物质的量分别为xy,结合质量和硫元素质量分数列式计算;
(3)由N、O、F三种元素组成的化合物Y的相对分子质量小于70大于60,其中氧元素的质量分数为49%,若含一个原子计算其摩尔质量,若含两个氧原子计算摩尔质量,依次计算判断;
解答 解:(1)氮元素与硫元素可形成一种化合物X.设X为NxSy,依据摩尔质量列式计算讨论得到化学式,X的摩尔质量为184g/mol,
14x+32y=184
x=$\frac{92-16y}{7}$
若y=1计算得到x=10.86,不是整数删去
y=2,x=8.57,不是整数删去
y=3,x=6.28,不是整数删去
y=4,x=4,符合
y=5,x=1.7不符合,
则化学式为N4S4,
故答案为:N4S4;
(2)设S2Cl2、SCl2的物质的量分别为xy,S2Cl2、SCl2的混合液体23.8g,混合物中S的质量分数为40.3%,结合质量和硫元素质量分数列式计算,
135x+103y=23.8
$\frac{(2x+y)×32}{135x+103y}$×100%=40.3%
x=0.1mol
y=0.1mol
S2Cl2、SCl2的物质的量之比为1:1,
故答案为:1:1;
(3)由N、O、F三种元素组成的化合物Y的相对分子质量小于70大于60,其中氧元素的质量分数为49%,若含一个氧原子则化合物摩尔质量=$\frac{16}{49%}$=32.65,不符合,若含两个氧原子,则摩尔质量近似为65,若含三个氧原子,摩尔质量=97.95不符合,化学式中含两个氧原子,65-32=33,依据N、F相对原子质量为14、19,得到化学式为:NFO2,
故答案为:NFO2;
点评 本题考查了物质组成的计算分析,化学式的确定方法,掌握基本的计算方法是解题关键,题目难度中等.


科目:高中化学 来源: 题型:解答题
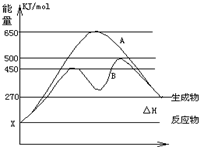 反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.试回答:
反应物与生成物均为气态的某可逆反应在不同条件下的反应历程分别为A、B,如图所示.试回答:查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碳和二氧化碳 | B. | 1mol 碳和3mol 碳 | ||
| C. | 3mol C2H2和1mol C6H6 | D. | 淀粉和纤维素 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 有4NA个电子转移时,放出890 kJ的能量 | |
| B. | 有NA个C-H键断裂时,放出890 kJ的能量 | |
| C. | 有2NA个H2O(l)生成时,放出890 kJ的能量 | |
| D. | 有NA个C、O间的共用电子对生成时,放出890 kJ的能量 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 碘水加到溴化钠溶液中:2Br-+I2═2I-+Br2 | |
| B. | 氯气溶于水:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 大理石溶于醋酸:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| D. | FeBr2溶液中通入少量的Cl2:Cl2+2Fe2+═2Fe3++2Cl- |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 钠跟水反应:Na+H2O═Na++OH-+H2↑ | |
| B. | 向CuCl2溶液中加入氢氧化钠溶液:Cu2++2OH-═Cu(OH)2↓ | |
| C. | 盐酸与碳酸钙反应制备二氧化碳:CO32-+2H+═CO2↑+H2O | |
| D. | 等物质的量硫酸氢钠溶液与氢氧化钡溶液反应:H++OH-═H2O |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com